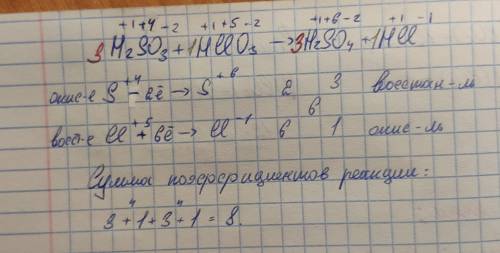С метода электронного баланса подберите коэффициенты в уравнении окислительно-восстановительной реакции: H₂SO₃ + НСlO₃ → H₂SO₄ + HCl. Укажите сумму коэффициентов реакции.
117
173
Ответы на вопрос:
ответ: 1. 4N⁻³H₃ + 5O₂⁰ = 4N⁺²O⁻² + 6H₂O
N⁻³ - 5e⁻ = N⁺² | 4 восстановитель, процесс окисления
O₂⁰ + 4e⁻ = 2O⁻² | 5 окислитель, процесс восстановления
2. 2KMn⁺⁷O₄ + 3K₂S⁺⁴O₃ + 2H₂O = 2Mn⁺⁴O₂ + 3K₂S⁺⁶O₄ + 2KOH
Mn⁺⁷ + 3e⁻ = Mn⁺⁴ | 2 окислитель, процесс восстановления
S⁺⁴ - 2e⁻ = S⁺⁶ | 3 восстановитель, процесс окисления
3. 3K₂Mn⁺⁶O₄ + 2H₂O = Mn⁺⁴O₂ + 2KMn⁺⁷O₄ + 4KOH
Mn⁺⁶ + 2e⁻ = Mn⁺⁴ | 1 окислитель, процесс восстановления
Mn⁺⁶ - e⁻ = Mn⁺⁷ | 2 восстановитель, процесс окисления
Объяснение: :
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Какой объем угликислого газа выделяется при горении 11.2 л. пропана...
 rfrfirb2016oy0uz314.02.2020 21:22
rfrfirb2016oy0uz314.02.2020 21:22 -
Электронная конфигурация внешнего слоя атома наиболее активного металла:...
 ArtemDem27.10.2021 01:40
ArtemDem27.10.2021 01:40 -
ТЕСТЫ ПО ХИМИИ ЖИРИ – ЦЕ ПОХІДНІ: а) гліцерину; б) етанолу; в) вищих...
 sveta19772011owor7w26.01.2021 15:59
sveta19772011owor7w26.01.2021 15:59 -
Який об’єм хлоридної кислоти з масовою часткою хлороводню 20% (ρ = 1,098...
 Vasilina8802.09.2021 16:52
Vasilina8802.09.2021 16:52 -
Розрахувати об’єм 15% розчину H 2 SO 4 (ρ = 1,105 г/см 3 ), необхідного...
 kazakovfiodor14.02.2020 20:07
kazakovfiodor14.02.2020 20:07 -
Каталітична реакція добування кисню: 2KClO3 = 2Cl+3O2. Поясніть роль...
 чина2203.10.2020 03:36
чина2203.10.2020 03:36 -
Який об єм водню( н.у) можна добути при взаємодії цинку кількістю речовини...
 АхМеД223328.01.2022 04:25
АхМеД223328.01.2022 04:25 -
Какое количество вещества фосфор(V) оксида прореагировало с водой, если...
 davidbezhasny008.04.2023 19:22
davidbezhasny008.04.2023 19:22 -
Напишіть формули речовин за їх назвою а)натрій два силіцій о три, б)ферум...
 oleegglazunov13.08.2021 21:40
oleegglazunov13.08.2021 21:40 -
сделать химию сделать химию!!! >...
 lineage21604.03.2022 09:03
lineage21604.03.2022 09:03

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.