Скажите , как понять, когда нужна кислота для реакции, а когда неметалл.
то есть для получения сульфида алюминия нужно:
2al+3s=al²s³
а для хлорида
2al+6hcl=2alcl³+ 3h²
Ответы на вопрос:
сложно объяснить, как понять. тут просто предсказать: неметаллы формируют только определенные соли. пример с
в этом случае мы получили нитрид натрия. такие вот взаимодействия с неметаллами. примерами могут так же стать простые реакции для получения оксидов:
вроде реакция привычна, но такая же. с примером у алюминия, сульфид алюминия так же можно получить при реакции алюминия с сероводором:
на школьном уровне объяснение простое: это происходит потому, что al активнее водорода, поэтому замещение происходит. к сожалению, это относится не ко всем:
так же относится к углероду:
однако получить из метана невозможно.
мой совет - запомнить некоторые реакции если вы не понимаете. на школьном уровне их немного.
4.7 грам
Объяснение:
Напишем уравнение реакции:
N₂ + 3H₂ = 2NH₃
Найдем количество вещества (H₂):
n (H₂) = 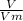 =
= 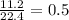 моль
моль
Из уравнения реакции составим пропорцию:
1 моль N₂ = 3 моль H₂ (1 и 3 это коэффициенты перед N₂ и H₂ соответственно)
X моль N₂ = 0.5 моль H₂
Отсюда:
Х = 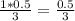 моль
моль
m (N₂) = n (N₂) × M (N₂) = 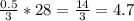 грам
грам
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Какой объем водорода выделяется при взаимодействии 10 грамм кальция с водой...
 elenabuda8516.02.2020 11:47
elenabuda8516.02.2020 11:47 -
Напишите степень окисления азота в веществах: (nh4)2co3; hno2; al(no3)3...
 denjis24.05.2023 15:50
denjis24.05.2023 15:50 -
Счем взаимодействует гидроксид калия?...
 Damir656516.11.2020 05:59
Damir656516.11.2020 05:59 -
На оксид магния массой 4 г подействовали раствором содержащим 15 г hno3. вычислить...
 Daxada22.08.2021 18:02
Daxada22.08.2021 18:02 -
Хлорид железа (ii) можно получить в результате реакции между веществами 1) fe+cl2...
 proxiv05.05.2021 09:49
proxiv05.05.2021 09:49 -
Закончить уравнение реакции. указать окислитель, восстановитель: so2+br2+h2o=...
 Sakinatabdylaeva04.12.2020 08:50
Sakinatabdylaeva04.12.2020 08:50 -
Бензен – хороший розчинник жирів. До якого класу сполук він відноситься? а) спирти;...
 DarkZlo05.07.2020 18:48
DarkZlo05.07.2020 18:48 -
Навеску стали массой 0,2548 г с содержанием марганца 1,09% раство- рили, окислили...
 Killer3D24.01.2021 15:18
Killer3D24.01.2021 15:18 -
1. Соединения с общей формулой СnH2n: 1) метилбензол 2) гептан 3) гептин 4) гептен...
 SVTBTN13.03.2021 13:10
SVTBTN13.03.2021 13:10 -
Определите степень гидролиза катиона в 0.01 М растворе нитрата свинца. ответ...
 nastyzotova1237803.01.2020 23:19
nastyzotova1237803.01.2020 23:19

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
