Сероводород(h2s),который был растворён в воде массой =74 г. был обработан гидроксидом железа(валентностью 3) массой = 97 г.
вычислите массу и количество осадка образовавшегося в конце реакции.
Ответы на вопрос:
дано:
m(h2s)=74 г
m( fe(oh)3 )=97г
найти:
n(fe2s3)-?
m(fe2s3)-?
решение:
3h2s + 2fe(oh)3 = 6h2o + fe2s3↓
1)найдём количество вещества h2s:
n(h2s) = m/mr = 74г/34г/моль=2,18 моль
mr(h2s)=1*2+32=34 г/моль
2)найдем количество вещества fe(oh )3:
n( fe(oh )3 ) = m/mr = 97г / 110г/моль = 0,9 моль
mr( fe(oh )3 ) = 56+ 18*3 = 110 г/моль
3) h2s в избытке, значит расчёт ведём по fe(oh )3:
(соотнесём количество вещества и коэффициенты)
0,9 моль/2=х/1
х=0,45 моль - количество вещества fe2s3
4)найдём массу fe2s3:
m= n*mr = 0,45 моль * 208 г/моль = 93,6 г
mr(fe2s3) = 56*2 + 32*3 =208 г/моль
ответ:
n(fe2s3) - 0,45 моль
m(fe2s3) - 93,6 г
объяснение:
а) KCl ( 52,3% )
Пояснення:Для цього треба знайти масову долю калію у цих речовинах, за формулою:
a) KCl:ω ( K ) = 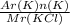
( тобто атомну масу калію множимо на його індекс та ділимо на молекулярну масу речовини, до складу якої він входить )
ω ( K ) = 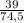 = 0,523 або 52,3%
= 0,523 або 52,3%
ω ( K ) = 39 × 2 = 78 / 174 = 0,445 або 44,5%
в) KHSO₄:ω ( K ) = 39 / 136 = 0,286 або 28,6%
г) KNO₃:ω ( K ) = 39 / 101 = 0,386 або 38,6%
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Сполным решение т,к, ничего не понимаю в хим ; d 1.определите молекулярную...
 zolotovavichka06.02.2023 21:07
zolotovavichka06.02.2023 21:07 -
1)напишите формулы веществ,1)напишите формулы веществ, образованных...
 MariaRosengard09.10.2020 10:50
MariaRosengard09.10.2020 10:50 -
Сравните s(сера) свойства с соседями по периоду...
 Аліномаг01.04.2021 10:39
Аліномаг01.04.2021 10:39 -
Составить реакцию c4h8 + hbr = нужна структурная формула...
 zarina1165312.06.2021 05:49
zarina1165312.06.2021 05:49 -
Какие из перечисленных солей подвергаются гидролизу: сa(no3)2 , k2so3...
 alenapanina0013.12.2021 12:42
alenapanina0013.12.2021 12:42 -
Ускільки разів масова частка нітрогену більша в амоній гідроксиді...
 LilauSen24.03.2021 12:34
LilauSen24.03.2021 12:34 -
Сокращенное и полное уравнение хлорида бария и нитрата серебра...
 mia7315.07.2021 19:05
mia7315.07.2021 19:05 -
Напишите электронные и структурные формулы кислот. h2so4 ; h2so3...
 Lisgg12343421.05.2020 09:25
Lisgg12343421.05.2020 09:25 -
Определите молярную концентрацию вещества в растворе ,содержащим...
 Kloloko19.04.2020 03:40
Kloloko19.04.2020 03:40 -
Определить массу водорода находящегося при нормальных условиях в...
 madinagiraevaM03.12.2021 07:19
madinagiraevaM03.12.2021 07:19

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
