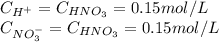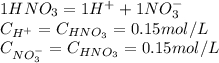Масса хлорида аммония ,полученного при взаимодействии аммиака массой 17 т с раствором,содержащим 73 т хлороводорода ,равна т решить,если можно с уравнением
161
224
Ответы на вопрос:
Дано: m(nh3)=17 т. m(hcl)=73 т. найти: m(nh4cl)= решение: уравнение реакции: т.к. у нас даны массы обоих исходных компонентов, надо определить какого из них меньше по количеству вещества (молям). n(nh3)= \frac{m(nh3)}{m(nh3)} =17 000 000/17= 1 000 000 моль n(hcl)=\frac{m(hcl)}{m(hcl)} = 73 000 000 / 36,5 = 2 000 000 моль т.к. nh3 меньше, чем hcl, значит и реакция прекратится когда закончится nh3. следовательно дальнейшие расчеты ведем по nh3. в соотвествии с коэф. стехиометрии реакция происходит 1к1, следоватиельно n(nh4cl)=n(nh3)=1 000 000 моль. m(nh4cl)= 53,5 г/моль. m(nh4cl)=n(nh4cl) * m(nh4cl) = 1 000 000 * 53,5 = 53 500 000 г = 53,5 т. ответ: получится хлорид аммония массой 53,5 т. у вас в школе вместо n может использоваться ню (v наклоненная) - количество молей.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
При взаимодействии 5, 6 г. железа с 6,4 г. серы образуется сульфид железа массой?...
 Aidos201115.12.2020 01:17
Aidos201115.12.2020 01:17 -
Какое из перечисленных названий является названием чистого вещества инертный газ...
 Alenadobro9707.10.2021 08:46
Alenadobro9707.10.2021 08:46 -
Вэвдиометре взорвали смесь водорода и кислорода объемом 65 мл , в результате образовалась...
 makssanchuk08.08.2022 09:56
makssanchuk08.08.2022 09:56 -
1.Ковшик. слюнки 2. Побег. озеро 3.Сорочки. борода Марья - царевна Младенец пирог...
 Владс11920.11.2021 00:53
Владс11920.11.2021 00:53 -
5. Розмістіть речовини в порядку зменшення катіонів в розчині при повній дисоціації...
 Dirolling14.11.2022 07:05
Dirolling14.11.2022 07:05 -
Металлы среди неметаллов. ребят, сор...
 христяч18.07.2021 01:23
христяч18.07.2021 01:23 -
Який об єм карбон(IV) оксиду (н.у.)виділиться при спалюванні 3 моль пропану?...
 jjiki07.08.2022 11:27
jjiki07.08.2022 11:27 -
Запишите уравнения реакции гидролиза соли, укажите среду и цвет лакмуса в ней а)...
 asadhfdgj16.12.2020 17:59
asadhfdgj16.12.2020 17:59 -
1.Із запропонованого переліку виберіть формули складних речовин: HNO3, K20, S,...
 Mesakea03.11.2022 22:32
Mesakea03.11.2022 22:32 -
3. а). Согласно закону Авогадро, 1 моль любого газа при нормальных условиях занимает...
 krasivak06.10.2021 14:59
krasivak06.10.2021 14:59

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.