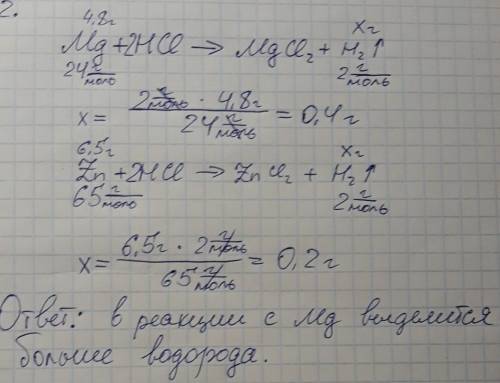Вычислите массу оксида углерода (iv), который можно получить при взаимодействии 7 г карбоната кальция с 30 г р-ра соляной кислоты с массовой долей hcl 20%, если выход составил 90% от теоретического. 75 , но прошу с "дано" и с подробным решением и со всеми необходимыми формулами.
163
405
Ответы на вопрос:
Дано m(caco3)=7 g m(ppa hcl)=30 g w(hcl)=20% η=90% m( находим масса вещества hcl m(hcl)=m(ppahcl)*w(hcl) /100%=30*20/100=6 g составляем уравнения 7g 6g xg caco3+2hcl--> cacl2+co2+2h2o 100 44 m(caco3)=100g/mol m(hcl)=36.5 g/mol m(co2)=44 g/mol n(caco3)=m/m=7/100=0.07 mol n(hcl)=m/m=6/36.5=0.16 mol n(caco3)< n(hcl) 7/100 = x/44 x=3.08 г- выход теоретический m(co2)=3.08*90%/100%=2.772 g ответ 2.772г
Дано: m(caco3)=7 г m(p-p)=30 г w(hcl)=20% r=90% найти: m(co2) решение: запишем уравнение реакции: caco3+2hcl--> h2o+co2↑+cacl2 найдем количества карбоната кальция и хлороводорода: n(caco3)=m/m=7г/100г/моль=0,07 моль n(hcl)=m(hcl)/m(hcl)=m(p-p)*w/m(hcl)=30г*0,2/36,5г/моль=0,1644 моль как видно, хлороводород в избытке, т.к. 2*n(caco3)=0,14 моль - меньше, чем n(hcl). значит, расчеты будем проводить по карбонату кальция. n(co2)=r*n(caco3)=0,9*0,07моль=0,063 моль - где r - выход продукта. m(co2)=n*m=0,063моль*44г/моль=2,772 г
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Как определить валентность по строению атомов...
 Учебниккнига10.04.2022 20:25
Учебниккнига10.04.2022 20:25 -
2. як можна визначити пробірку з розчином хлоридної кислоти серед пробірок...
 FantomLord2403.09.2021 19:36
FantomLord2403.09.2021 19:36 -
Как определить свойства элементов по строению атома...
 ооо32212.07.2020 14:15
ооо32212.07.2020 14:15 -
Решите ,заранее большое! 100 за верное решение. основным компонентом...
 Rorschach00110.07.2021 08:44
Rorschach00110.07.2021 08:44 -
Hbro3 - бромноватая кислота; h2sio3 - кремниевая кислота написать формулу...
 Лера11122233322.03.2022 10:44
Лера11122233322.03.2022 10:44 -
При горении аммиака в воздухе образуется...
 Алексей12341207.05.2022 08:06
Алексей12341207.05.2022 08:06 -
Вычислите объём аммиака(nh3) образовавшегося при взаимодействии 8 литров...
 kostya79bat125.09.2022 08:46
kostya79bat125.09.2022 08:46 -
Нужно письменно написать окислительно-восстановительные реакции...
 Сиплел03.09.2020 00:57
Сиплел03.09.2020 00:57 -
Чи можно приготувати насичений розчин з етанолу?...
 madinatrtyakov04.07.2022 13:34
madinatrtyakov04.07.2022 13:34 -
Написать тезисы к тексту...
 sobakazabiyaka08.10.2020 11:19
sobakazabiyaka08.10.2020 11:19

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.