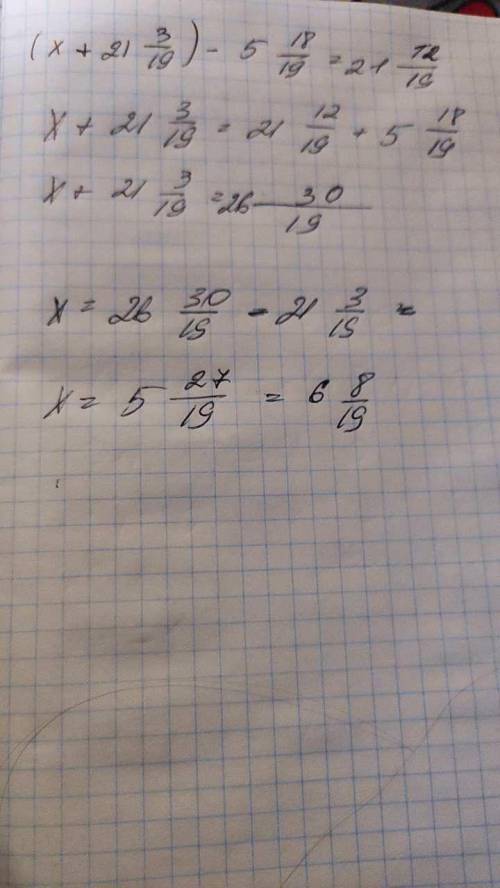Какие из солей: KNO3, CrCl3, Cu(NO3)2, NaCN – подвергаются гидролизу? Составьте молекулярные и ионные уравнения гидролиза соответствующих солей
219
419
Ответы на вопрос:
Все, кроме KNO3.
CrCl3 и Cu(NO3)2 - по катиону, NaCN - по аниону.
Гидролиз проходит преимущественно по 1 ступени, дальнейший гидролиз очень назначителен и требует особых условий, напр., сильного нагревания.
CrCl3 и Cu(NO3)2 образованы слабым основанием и сильной кислотой, гидролиз по катиону, среда кислая, pH <7.
CrCl3 → Cr3+ + 3Cl–
Cr3+ + H2O ⇆ CrOH2+ + H+ , CrCl3 + H2O ⇆ CrOHCl2 + HCl
Cu(NO3)2 ⇆ Cu2+ + 2NO3–
Cu2+ + H2O ⇆ CuOH+ + H+ , Cu(NO3)2 + H2O ⇆ CuOHNO3 + HNO3
NaCN образован сильным основанием и слабой кислотой, гидролиз по аниону, среда щелочная, pH>7
NaCN → Na+ + CN–
CN– + H2O ⇆ НCN + ОН- , NaCN + H2O ⇆ НCN + NaОН
CrCl3 и Cu(NO3)2 - по катиону, NaCN - по аниону.
Гидролиз проходит преимущественно по 1 ступени, дальнейший гидролиз очень назначителен и требует особых условий, напр., сильного нагревания.
CrCl3 и Cu(NO3)2 образованы слабым основанием и сильной кислотой, гидролиз по катиону, среда кислая, pH <7.
CrCl3 → Cr3+ + 3Cl–
Cr3+ + H2O ⇆ CrOH2+ + H+ , CrCl3 + H2O ⇆ CrOHCl2 + HCl
Cu(NO3)2 ⇆ Cu2+ + 2NO3–
Cu2+ + H2O ⇆ CuOH+ + H+ , Cu(NO3)2 + H2O ⇆ CuOHNO3 + HNO3
NaCN образован сильным основанием и слабой кислотой, гидролиз по аниону, среда щелочная, pH>7
NaCN → Na+ + CN–
CN– + H2O ⇆ НCN + ОН- , NaCN + H2O ⇆ НCN + NaОН
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Другие предметы
-
Для задачи своей РГР подобрать размер прямоугольного сечения балки из условия...
 fagev21.07.2021 10:55
fagev21.07.2021 10:55 -
Ахахах странный вопрос но что означает / этот знак например когда пишут х/2 1/2...
 Babikovandrei4820.01.2023 13:17
Babikovandrei4820.01.2023 13:17 -
Контрольна робота з зарубіжної літератури «Вступ. Билини і балади» Варіант 1 Населений...
 trolz66612.05.2023 07:04
trolz66612.05.2023 07:04 -
1. Какая древесина на токарном станке хорошо обрабатывается , а какая хуже? 2....
 kotofrei23126.05.2021 20:46
kotofrei23126.05.2021 20:46 -
расставить артикли в ПОРТУГАЛЬСКОМ ЯЗЫКЕ...
 Dmitry023214104.07.2020 06:56
Dmitry023214104.07.2020 06:56 -
Примеры поступков человека сильным по этике контрольный вопрос 6 класса...
 margaritabennioxwu8x07.01.2022 13:31
margaritabennioxwu8x07.01.2022 13:31 -
1. с каким ускорением движется тело брошенное под углом горизонта? причина ускорения...
 анна179624.03.2022 20:51
анна179624.03.2022 20:51 -
Нужно составь свой словарик к тексту повести на всякий случай...
 atodyshevoxz3kh09.10.2021 00:20
atodyshevoxz3kh09.10.2021 00:20 -
Сколько сможете, буду ! 9 класс. 1) на пути 60м скорость тела уменьшилась в 3...
 НуриманН30.03.2021 16:55
НуриманН30.03.2021 16:55 -
Точка м лежит на отрезке ав. отрезок ав пересекается с плоскостью альфа в точке...
 ВикаKull12.09.2022 08:44
ВикаKull12.09.2022 08:44

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.