Уравнения реакций so2+h2o= p2o5+naoh= h2so4+ba(oh)2= mg+hbr= hno3+na2sio3=
Ответы на вопрос:
С) уменьшение концентрации 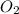
Объяснение:
Если:
-температура
-повышается, то равновесие сместится в сторону эндотермической реакции;
-понижается, то равновесие сместится в сторону экзотермической реакции;
-давление
-повышается, то равновесие повышается сместится в сторону образования меньшего числа молекул;
-понижается, то равновесие сместится в сторону образования большего числа молекул;
-концентрация
исходных веществ увеличивается, то равновесие сместится в сторону образования продуктов реакции;
продуктов реакции увеличивается, то равновесие сместится в сторону образования исходных веществ.
А) равновесие сместится в сторону образования продуктов реакции(экзотермической является прямая реакция(+Q))
В) равновесие сместится в сторону образования продуктов реакции(3 моль исходных веществ - 2 моль продуктов реакции)
С) равновесие сместится в сторону образования исходных веществ(уменьшилась концентрация исходного вещества)
D) равновесие сместится в сторону образования продуктов реакции(уменьшилась концентрация продукта реакции)
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Fe+2hcl= mg+2hcl= hcl+al= h2o-h2-hcl-h= 1)расположите формулы металлов: барий,...
 nikaaleksievich04.10.2020 17:24
nikaaleksievich04.10.2020 17:24 -
Напишите уравнения реакций, с которых можно осуществить цепочку превращения...
 marina1976117.03.2022 21:09
marina1976117.03.2022 21:09 -
Из ниже формул солей выберете кислую соль. а) na2co3 б) k2[fe(so4)2] в) (caoh)2so3...
 робот6001.11.2020 15:56
робот6001.11.2020 15:56 -
Сера образует два оксида какие название имеют эти оксиды? в каком из них...
 Daria231619.02.2021 22:10
Daria231619.02.2021 22:10 -
Вычислить молярную массу эквивалента трехвалентного металла, если известно,...
 YTTeamGardnYT26.06.2023 08:03
YTTeamGardnYT26.06.2023 08:03 -
Какие из веществ реагируют с концентрированной серной кислотой: медь,оксид...
 Fizun09.01.2022 00:54
Fizun09.01.2022 00:54 -
3-амино-2бром-2метилпентен-4-овая кислота. составить из этого цепь...
 sirentuhfatull10.09.2020 20:07
sirentuhfatull10.09.2020 20:07 -
Чему равна эквивалентная масса фосфорной кислоты ( mr=98) в реакции н3ро4+naoh=nah2po4+h2o?...
 arsenibest0324.11.2022 11:28
arsenibest0324.11.2022 11:28 -
Какой металл более гибкий Кальций или Магний?...
 vikshaaa22.07.2021 08:08
vikshaaa22.07.2021 08:08 -
Выберите вещества, в которых есть природные щелочи Верных ответов: 2 уксусная...
 tipikina201615.04.2020 09:50
tipikina201615.04.2020 09:50

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
