44 за правильный ! ! 1.натрий хлорид массой 6 г растворили в воде массой 194 г. вычислите массовую долю натрия хлорида в образованном растворе. 2.в воде массой 450 г растворили калий сульфат массой 50 г. вычислите массовую долю соли в образованном растворе. 3.вычислите массу калий гидроксида, содержащийся в растворе массой 60 г, если массовая доля щелочи в нем равна 0,02 4.к 300 г 20% раствора гидроксида натрия добавили 200мл воды. вычислите массовую долю щелочи в новообразованном растворе.
178
381
Ответы на вопрос:
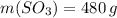
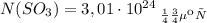
Объяснение:
Оксид серы (VI) - это соединение шестивалентной серы с кислородом, степень окисления которого как правило равна (-2) - т.е. SO3.
Всего у нас 5 моль SO3
Масса вещества равна произведению количества вещества на его молярную массу
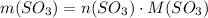
Вычислим молярную массу SO3:
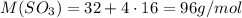
Найдем массу 5 моль SO3
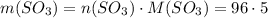
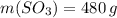
Количество молекул вещества равно произведению количества этого вещества на число молекул в 1 моль вещества (стандартное значение)
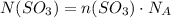
где
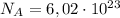
Отсюда:
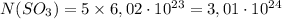
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
К3л 10% раствора азотной кислоты плотностью 1,054г/мл прибавили 5л 2% раствора...
 123296027.07.2022 08:28
123296027.07.2022 08:28 -
Напишите уравнение реакции в молекулярном, полным и сокращенным йонным видом между...
 ренат7623.06.2021 10:29
ренат7623.06.2021 10:29 -
P__активныйнм, чем si че�. p__активныйнм, чем si активный чем s (укажите знак...
 Akale22.12.2022 05:16
Akale22.12.2022 05:16 -
Укажите заряды ионов и степени окисления атомов элементов для веществ с формулами:...
 karkavina8522.02.2021 07:39
karkavina8522.02.2021 07:39 -
C2h2 + 2h2 =c2h2 энергетика реакций...
 nastyaasdfg02.04.2021 20:50
nastyaasdfg02.04.2021 20:50 -
Раставте кафициэты zn+o2= p+o2= c2h4+o2= k+h2o= al+hci=...
 Костя4563225.05.2023 01:32
Костя4563225.05.2023 01:32 -
1. УКАЖІТЬ Клас СПОЛУК, ДО ЯКОГО належHTь аНІЛІН: 10 а) нітросполуки; б) циклоалкани;...
 Ali2007101122.10.2020 04:38
Ali2007101122.10.2020 04:38 -
Укажіть оксид, який взаємодіє з калій гідроксидом а) сульфат (4) оксид б) натрій...
 KOROTKOVAKATA27.07.2020 04:37
KOROTKOVAKATA27.07.2020 04:37 -
Зазнач назву кислоти HNO2 та запиши значення її молярної маси...
 AnnHaylen11.05.2020 08:17
AnnHaylen11.05.2020 08:17 -
Який об єм кисню (н.у.) виділиться у результаті розкладу 9,8 г. бертолетової солі...
 vladik2ppp02.06.2021 23:11
vladik2ppp02.06.2021 23:11

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
