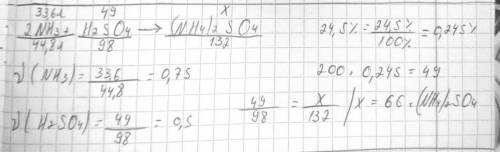Оксид хрома (vi) массой 1,42 г растворили в воде. через полученный раствор пропустили избыток диоксида серы, а затем добавляли раствор аммиака до прекращения образования осадка. полученный осадок отделили от раствора и прокалили.напишите уравнения реакций.почему для осаждения осадка на раствор действовали раствором аммиака, а не раствором щелочи? подтвердите объяснение уравнением реакции.порошок, какого вещества можно добавить вместо раствора аммиака, чтобы добиться аналогичного результата? как называется протекающий при этом процесс? напишите уравнение реакции.вычислите массу остатка после прокаливания.
152
351
Ответы на вопрос:
1) n cro3 (м = 100 г/моль) = 1.42/100 = 0.0142 моль; 2) cro3-> h2cro4-> 0.5cr2(so4)3-> cr(oh3)-> 0.5cr2o3 (м = 152 г/моль) - масса cr2o3 составит 152*0.0142*0.5 = 1.0792 г; 3) а) cro3 + h2o = h2cro4; б) 2h2cro4 + 3so2 = cr2(so4)3 + 2h2o; в) cr2(so4)3 + 6nh3*h2o = 2cr(oh)3↓ + 3(nh4)2so4; г) 2cr(oh)3 = cr2o3 + 3h2o; 4) т.к. cr(oh)3 - амф-й гидроксид, он раств-ся в сильных осн-х (щелочах): cr(oh)3 + 3koh = k3[cr(oh)6]; 5) можно исп-ть водораств-й сульфид (например na2s) для осаждения cr(oh)3 - прот-т полный взаимный гидролиз: cr2(so4)3 + 3na2s + 6h2o = 2cr(oh)3↓ + 3h2s↑ + 3na2so4.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Каков состав и какова масса соли,которая образуется при пропускании 26,88 мл co2...
 skrylnikvozvyb609.09.2022 10:58
skrylnikvozvyb609.09.2022 10:58 -
Втрех пробирках без этикеток содержатся растворы магния сульфата, алюминий сульфата...
 ЮлияМарченкова13.05.2023 12:17
ЮлияМарченкова13.05.2023 12:17 -
Определить вид связи и тип кристалической решетки в следующих веществах: флорид...
 anigrigoryan0128.11.2022 08:14
anigrigoryan0128.11.2022 08:14 -
Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет...
 kristinэ04.03.2023 15:56
kristinэ04.03.2023 15:56 -
Составьте уравнения реакций этилена с веществами: а) кислород ( б) вода ( в) водород...
 3333п28.03.2022 13:28
3333п28.03.2022 13:28 -
Кальций массой 16 г прореагировал с водой массой 60 г. определите массовую долю(%)гидроксида...
 Bbqqall17.06.2021 15:32
Bbqqall17.06.2021 15:32 -
Учитывая положение кислорода, серы и селена в переодической таблице и их электроотрицательности,...
 ArseniiB114.09.2020 07:24
ArseniiB114.09.2020 07:24 -
Сколько грамм серебра получается в следствии окисления 6,8 моль глюкозы аммониачным...
 liza77014.04.2020 14:13
liza77014.04.2020 14:13 -
Напишите молекулярные и инно-молекулярные уравнения реакций получения хлорида кальция...
 Метеор7310.06.2022 14:43
Метеор7310.06.2022 14:43 -
Чем различаются по строению нейтральные атомы и ионы: cl и cl с зарядом -1 mg и...
 katrin0506912.02.2023 07:44
katrin0506912.02.2023 07:44

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.