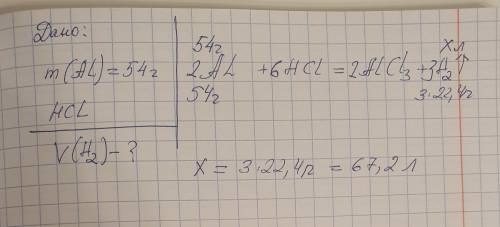Який обʼєм газу виділиться (н.у.), якщо алюміній масою 54 г повністю прореагує з хлоридною кислотою?
233
299
Ответы на вопрос:
Хлоридна кислота (HCl) реагує з алюмінієм (Al) за рівнянням:
2Al + 6HCl → 2AlCl₃ + 3H₂
З рівняння видно, що для повної реакції з 2 молекулами алюмінію (2Al), потрібно 6 молекул хлоридної кислоти (6HCl).
Тому, для реагування 54 г алюмінію, потрібно розрахувати кількість речовини (моли), використовуючи молярну масу алюмінію (молярна маса Al = 27 г/моль):
моль Al = маса Al / молярна маса Al = 54 г / 27 г/моль = 2 моля алюмінію
За рівнянням реакції, 2 моля алюмінію (2Al) реагують з 6 молями хлоридної кислоти (6HCl), що дає 3 моля водню (3H₂).
Отже, при повній реакції, утвориться 3 моля газу водню.
Нагадую, що умови "н.у." (нормальні умови) включають температуру 0 °C (273 K) і тиск 1 атмосфери (101.3 кПа).
Число протонов и электронов равно ( порядковый номер элемента ) =42p+, e- а кол-во нейтронов вычисляется "относительная атомная масса : число протонов" =96-42=54n°
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Дайте ПОЛНУЮ характеристику элементов с порядковыми номером 14 19...
 dashden35424.06.2021 07:39
dashden35424.06.2021 07:39 -
Вычеслить массовую долю растворенной вещества ,если в 300 воды растворили...
 Нолик2728.07.2020 01:06
Нолик2728.07.2020 01:06 -
Химический метод (холодный) — проводится Химическими растворами: Выберите...
 NuriEynullaeva23.11.2020 19:06
NuriEynullaeva23.11.2020 19:06 -
AL4C3-CH4-CH3CL-C2H5-CO2 на нужно ...
 azazaka22013.03.2022 21:12
azazaka22013.03.2022 21:12 -
Какие органы обозначены на рисунке цифра-орган биология...
 fefmweoiwefio09.10.2022 04:34
fefmweoiwefio09.10.2022 04:34 -
Приготовить 5 кг 8,3 % раствора хлористоводородной кислоты из 37 %....
 арсений21330.04.2023 01:25
арсений21330.04.2023 01:25 -
Скильки мистыться атомив у зализи масою 28 г...
 neznakomka140801.01.2023 20:11
neznakomka140801.01.2023 20:11 -
Цепочка превращения осталось 15 минут : C→CO→CO2→H2CO3↓ (вниз) Ca(HCO3)2→CO2...
 skilletsk04.08.2022 16:36
skilletsk04.08.2022 16:36 -
Схема образования молекул K3P...
 Макс91757216.11.2021 13:53
Макс91757216.11.2021 13:53 -
Установите формулу ацетиленового углеводорода, относительная плотность...
 karinochka66622.08.2020 06:33
karinochka66622.08.2020 06:33

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.