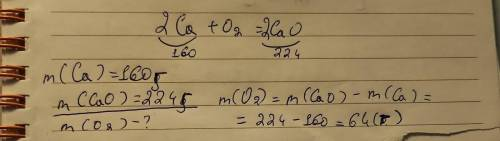Під час горіння 160 г кальцію утворилось 224 г кальцій оксиду. Складіть відповідне рівняння реакції і визначте масу кисню, що прореагував.
174
404
Ответы на вопрос:
Відповідь:
Під час горіння кальцію з киснем утворюється кальцій оксид. Рівняння цієї реакції виглядає так:
2Ca + O2 → 2CaO
З рівняння видно, що 2 моля кальцію реагують з 1 молем кисню, тобто 40 г кальцію реагують з 32 г кисню.
Отже, щоб визначити масу кисню, що прореагував, потрібно відняти масу кисню, яка залишилась у кальцій оксиді від загальної маси кисню в реакції:
Маса кисню, що прореагував = маса кисню в реакції - маса кисню, який залишився у CaO
Маса кисню в реакції: 224 г CaO = (40 г Ca / 40 г/моль) + (x г O / 16 г/моль)
Розв'язуючи рівняння, отримаємо масу кисню: x = 64 г
Отже, маса кисню, що прореагував, дорівнює 64 г.
Пояснення:
1) c6h12br2+zn=c6h12+znbr2 c6h12=c6h6+3h2 (реакция идет в присутствии ni, t) 5c6h5ch3+6kmno4+9h2so4=5c6h5cooh+6mnso4+3k2so4+14h2o бензол в реакцию не вступает 2) дегидроциклизация алканов: c6h14 = c6h6 + 4h 2 (реакция при температуре и катализаторе) алкилирование бензола: c6h6 + c2h5-cl = c6h5-c2h5 + hcl (реакция при температуре и alc3) 3) предельный - гексан ch3-ch2-ch2-ch2-ch2-ch3=c6h6+4h2 (реакция при температуре и pt) непредельный - ацетилен 3c2h2=c6h6 (реакция при температуре и катализаторе)
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Вычислите массу соли, образовавшейся в результате реакции нейтрализации...
 supermen201827.03.2022 07:11
supermen201827.03.2022 07:11 -
Який об єм води та масу натрію хлориду , треба взяти щоб приготувати 100...
 bosschornoguz28.09.2022 18:42
bosschornoguz28.09.2022 18:42 -
11. Какая масса сульфата бария образуется при взаимодействии 171 г 10% раствора...
 romazan426.03.2023 11:53
romazan426.03.2023 11:53 -
1.какой источник света использовал Н Ньютон в своем опыте? а) тепловой;...
 tititititititi06.09.2022 00:28
tititititititi06.09.2022 00:28 -
решить ! 1. Несколько кристалликов фенола взболтали в пробирке с водой....
 DIMAZVER198010.04.2022 03:00
DIMAZVER198010.04.2022 03:00 -
Які маси кристалізаційної води та безводної солі містять у кристалогідраті...
 barmin2001g01.08.2020 18:27
barmin2001g01.08.2020 18:27 -
Каким методом можно разделить указанные смеси веществ? 1) Деревянные опилки...
 DarvinaDark15.02.2021 19:31
DarvinaDark15.02.2021 19:31 -
3. Дана реакция ZnO(т) +CO(г) = Zn(т) + CO2(г), ΔН = 67,6 кДж, ΔS = 14,1...
 Etopizdato27.11.2021 20:23
Etopizdato27.11.2021 20:23 -
. Які рівняння називають йонно-молекулярними? 2. Формули яких речовин у...
 020827.12.2020 12:55
020827.12.2020 12:55 -
Дать названия веществам : а) с-с-с-с-с б)с=с-с-с в)с=с-с=с-с-с-с...
 zurkus11223.04.2022 15:46
zurkus11223.04.2022 15:46

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.