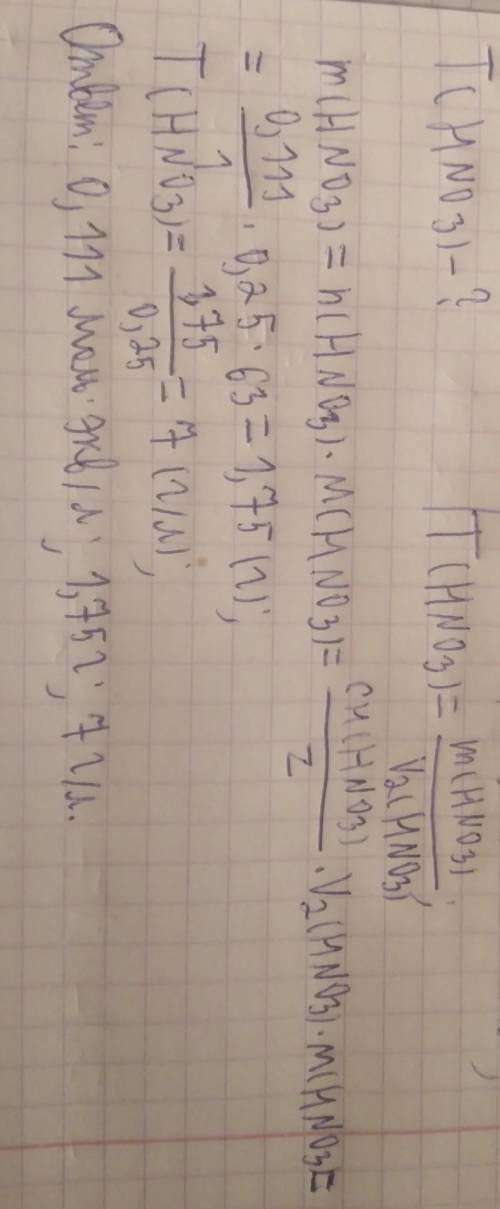На титрування 20 мл розчину HNO3 витратили 18,5 мл розчину NaOH з молярною концентрацію еквівалента 0,12 моль/л. Розрахуйте молярну концентрацію еквівалента, титр і масу HNO3 в розчині об’ємом 250 мл
134
242
Ответы на вопрос:
Дано: m(nacl,kcl)=25г m(р-ра agno₃)=500г ω(agno₃)=14.3%=0.143 m(cu)=100г m(новой пл.)=101.52г найти: ω( ω( решение: 1): пусть в смеси было "х"моль-nacl и "у"моль-kcl.тогда: m(nacl)=58.5г/моль ,n(nacl)="x" моль => m(nacl)=58.5x г m(kcl)=74.5г/моль ,n(kcl)="у" моль => m(kcl)=74.5y г 2): nacl+agno₃> nano₃+agcl↓ kcl+agno₃> kno₃+agcl↓ в фильтрат опустили медную проволоку: cu+> cucl₂+2ag допустим,что в реакции усавствует 1моль(64г)меди,тогда масса пластинки увеличится на : m(ag)*2-m(cu)=108*2-64=152г ,следовательно, 1.52/152=0.01моль - меди прореагировало,тогда в реакцию вступило n(agno₃)=2*n(cu)=0.02моль или m(agno₃)=n(agno₃)*m(agno₃)=0.02*170=3.4г на реакцию со смесью хлоридов натрия и калия использовалось : m(agno3)=500*0.143-3.4=68.1г => n(agno₃)=68.1/170=0.4моль n(agno₃)=n(nacl)="x" моль n(agno₃)=(kcl)="у" моль х+у=0.43): решаем систему: 4): n(nacl)=0.3моль => ω(nacl)=(58.5*0.3)/25=0.702=70.2% n(kcl)=0.1моль => ω(kcl)=(74.5*0.1)/25=0.298=29.8% ответ: ω(nacl)=70.2% ; ω(kcl)=29.8%.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Скакими из перечисленных веществ реагирует так фенилаланин : серная кислота...
 Виталя23614.06.2020 13:03
Виталя23614.06.2020 13:03 -
Выберите явление: 1)кипение воды. 2)горение угля. 3)растворение сахара в воде....
 dzhusanastasia20.03.2023 15:24
dzhusanastasia20.03.2023 15:24 -
Напишите вещество с самой большой атомной массой, укажите её. заранее ))...
 zimnyayaдевочка24.12.2021 19:21
zimnyayaдевочка24.12.2021 19:21 -
Напишите уравнение реакций с которых можно осуществить следующие превращения...
 henriksenkids20.06.2022 16:55
henriksenkids20.06.2022 16:55 -
17)напишіть рівняння реакцій, за яких можна одер-жати калій сульфід, барій-флуорид,...
 Bioligy02.05.2021 05:01
Bioligy02.05.2021 05:01 -
Ссоединение с кислородом, формула которого эо (2),образует элемент 1) na 2)...
 rih90450720.08.2020 16:52
rih90450720.08.2020 16:52 -
Классифицируйте вещество, укажите класс и назовите каждое вещество ...
 Ева17128207.06.2021 22:28
Ева17128207.06.2021 22:28 -
Знайти масу етанолу отримано в результаті гідролізу 250г етилпропаноату , що...
 Илья251921.12.2021 21:06
Илья251921.12.2021 21:06 -
Яка маса осаду утвориться при дії 5,85 натрій хлориду аргегтум нітрат...
 кузя21614.08.2020 17:31
кузя21614.08.2020 17:31 -
Масова частка карбону у вуглеводі 85.7% .відносна густина за повітрям 1.93....
 Liya2003421.10.2022 23:36
Liya2003421.10.2022 23:36

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.