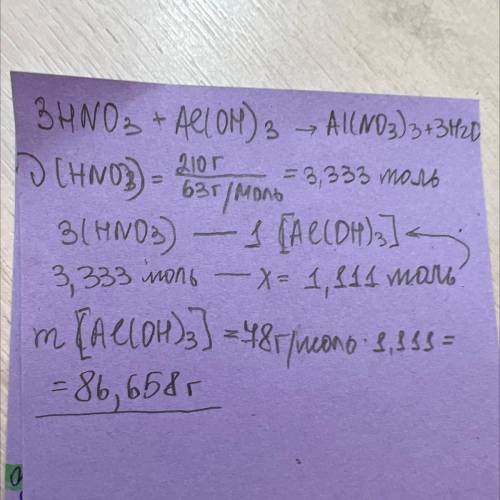Сколько граммов гидроксида алюминия можно растворить в азотной кислоте массой 210г?
203
276
Ответы на вопрос:
1) mn⁺²so₄+pb⁺⁴o₂+hno₃ ⇒ pb(no₃)₂ +pb⁺²so₄ + h₂o + hmn⁺⁷o₄mn⁺² - 5e⁻⇒ mn⁺⁷ 5 2 восстановитель, процесс окисления 10pb⁺⁴ +2e⁻⇒ pb⁺² 2 5 окислитель, процесс восстановления 2mnso₄+ 5pbo₂+ 6hno₃ = 3pb(no₃)₂ +2pbso₄ + 2h₂o + 2hmno₄ 2) mn⁺⁴o₂ + pb⁺⁴o₂ + hno₃ ⇒hmn⁺⁷o₄ + pb⁺²(no₃)₂ + h₂o mn⁺² - 5e⁻⇒ mn⁺⁷ 5 2 восстановитель, процесс окисления 10pb⁺⁴ +2e⁻⇒ pb⁺² 2 5 окислитель, процесс восстановления 2mno₂ + 5pbo₂ + 10hno₃ =2hmno₄ + 5pb(no₃)₂ + 4h₂o 3) fe⁺²so₄ + mn⁺⁴o₂ + h₂so₄⇒ fe₂⁺³(so₄)₃ + mn⁺²so₄ + h₂ofe⁺² - e⁻⇒ fe⁺³ 1 2 восстановитель, процесс окисления 2mn⁺⁴ +2e⁻ ⇒mn⁺² 2 1 окислитель, процесс восстановления 2feso₄ + mno₂ +2h₂so₄ = fe₂(so₄)₃ + mnso₄ + 2h₂o4) k₂mn⁺⁶o₄ + cl₂⁰ ⇒ kmn⁺⁷o₄ + kcl⁻mn⁺⁶- e⁻⇒ mn⁺⁷ 1 восстановитель, процесс окисления cl⁰ + e⁻ ⇒cl⁻ 1 окислитель, процесс восстановленияk₂mno₄ + cl₂ = kmno₄ + 2kcl5) cr₂⁺³(so₄)₃ + kmn⁺⁷o₄ + h₂o ⇒ k₂cr₂⁺⁶o₇ + mn⁺⁴(oh)₄ + h₂so₄ cr⁺³-3e⁻⇒cr⁺⁶ 3 1 восстановитель, процесс окисления 3 mn⁺⁷ +3e⁻⇒mn⁺⁴ 3 1 окислитель, процесс восстановления cr₂(so₄)₃ + 2kmno₄ + 7h₂o= k₂cr₂o₇ + 2mn(oh)₄ + 3h₂so₄
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Кислотные свойства наиболее ярко выражены у высшего периода 1) азот...
 LinaKosarchuk14.03.2021 20:52
LinaKosarchuk14.03.2021 20:52 -
Вместо многоточий поставте слова молекула или атом . в воды входят кислорода...
 Antonio1111111111.03.2022 16:45
Antonio1111111111.03.2022 16:45 -
Закончите уравнения реакций и расставьте коэффициенты.для уравнения...
 adamannik12.01.2020 09:55
adamannik12.01.2020 09:55 -
Ti(oh)4, so3, na2cr2o7, h2seo4укажите названия соединений, определите...
 seimar223.02.2022 14:51
seimar223.02.2022 14:51 -
1. чем реакции отличаются от явлений? 1. изменение формы, агрегатного...
 меланамасимова03.08.2020 15:22
меланамасимова03.08.2020 15:22 -
100 баллов!!! Ферум(3+) барій амоній хлоридна кислота, газ із характерним...
 AnzhelaBagdasaryan30.08.2021 06:02
AnzhelaBagdasaryan30.08.2021 06:02 -
Обчислити об єм хлору який витратили для добування хлоретану масою 40...
 anastas25a02.04.2023 01:50
anastas25a02.04.2023 01:50 -
Na→Na2O→NaOH→Na2SO4→ BaSO4→Ba(OH)2→ Cu(OH)2 Пишемо рівняння ось так,...
 ksuz17.11.2020 10:48
ksuz17.11.2020 10:48 -
Молекулярное и сокращенное ионное уравнение нитрат натрия. напишите...
 maezsa05.10.2022 18:30
maezsa05.10.2022 18:30 -
Закончите уравнения практически осуществимых реакций,схемы которых ниже:...
 ryzhovaelena109.12.2022 14:53
ryzhovaelena109.12.2022 14:53

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.