Продуктом обработки смеси глюкозы и рибозы аммиачным раствором оксида серебра явилось 43,2 г осадка. При сжигании этой же смеси образуется углекислый газ, который, реагируя с Ca(OH)2, образует 110 г осадка. Определить массовые доли углеводов
Ответы на вопрос:
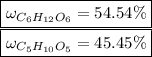
Объяснение:
УравненияСоставим все уравнения реакций:
1) Глюкоза с аммиачным раствором оксида серебра
![C_6H_{12}O_6+2[Ag(NH_3)_2]OH \xrightarrow{t^{\circ }}C_6H_{11}O_6ONH_4+2Ag \downarrow +3NH_3 \uparrow + H_2O](/tpl/images/4867/7838/2c98c.png)
2) Рибоза с аммиачным раствором оксида серебра:![C_5H_{10}O_5+2[Ag(NH_3)_2]OH \xrightarrow{t^{\circ }}C_5H_9O_5ONH_4+2Ag \downarrow + 3NH_3 \uparrow +H_2O](/tpl/images/4867/7838/c5b23.png)
3) Горение глюкозы: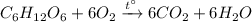
4) Горение рибозы: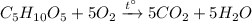
5) Реакция нейтрализации: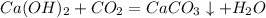
Найдем количество вещества серебра через данное:
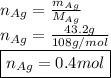
Обозначим количество вещества углеводов через переменные:
Пусть было x моль глюкозы и y моль рибозы
Тогда количество вещества серебра в уравнении 1) равно 2x:
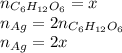
А количество вещества серебра в уравнении 2) равно 2y: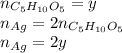
Тогда общее количество вещества серебра равно 2x+2y или 0.4 моль:
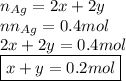
Найдем количество вещества осадка в уравнении 5):
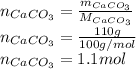
Так как коэффициенты перед углекислым газом и карбонатом равны, то:
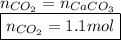
Из уравнения реакции горения глюкозы видно, что количество вещества углекислого газа равно 6x:
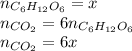
А из уравнения реакции горения рибозы видно, что количество вещества углекислого газа равно 5y:
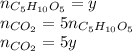
Итого: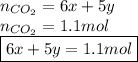
Имеем систему:
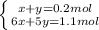
Решая уравнение получим:
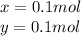
Найдем массу каждого углевода:
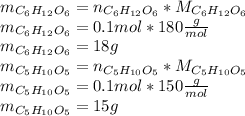
Тогда общая масса равна:
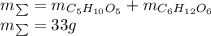
Тогда массовые доли равны:
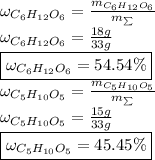
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Вычислите относительную молекулярную массу и массовые доли элементов...
 ironthewolf7202.06.2023 15:43
ironthewolf7202.06.2023 15:43 -
Определите, является ли раствор насыщенным или ненасыщенным! (а)...
 Комарова2320.09.2021 22:54
Комарова2320.09.2021 22:54 -
Каков объем водорода получившегося при взаимодействии 5г сальция...
 elizavetkanaum16.05.2020 03:44
elizavetkanaum16.05.2020 03:44 -
Позначте з чим реагірує кісель : А) лише з речовинами Б) лише зі...
 SledjeTV11.08.2022 07:07
SledjeTV11.08.2022 07:07 -
1.Назвать вещества и определить степени окисления всех химических...
 тимур61702.03.2020 04:52
тимур61702.03.2020 04:52 -
Скорость реакции изменяется ____________ с течением времени. Более...
 Zufar161826.09.2020 10:45
Zufar161826.09.2020 10:45 -
Заполните пробелы !!!! Основания – это ________________ вещества,...
 катя506823.11.2021 20:15
катя506823.11.2021 20:15 -
До ть будь ласка з хімії.Треба сьогодні. Дивіться на фото. Хоча...
 polina200620016.07.2021 14:58
polina200620016.07.2021 14:58 -
Какой объём оксида азота (ii) может быть получен из 20 л аммиака...
 alinka1215200216.06.2020 03:06
alinka1215200216.06.2020 03:06 -
Почему для приготовления стандартных растворов берут навеску с...
 Эвджен01.02.2022 17:15
Эвджен01.02.2022 17:15

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
