1. В длинной периодической таблице химических элементов показаны несколько элементов W 2 Х Y F Определите элементы, которые имеют одинаковое количество электронов на внешне энергетическом уровне плззз
110
361
Ответы на вопрос:
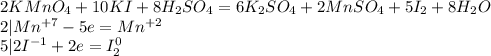
Объяснение:
Запишем уравнение:
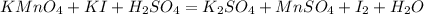
Расставим степени окисление и оставим их только у тех кто меняет их:
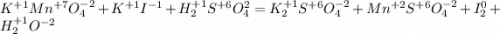
Останется:
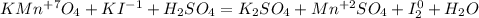
Запишем ОВР редокс для марганца и йода:
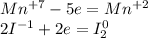
Перед йодом коэффициент 2, так как справа уже есть 2 йода, уравняем электроны:
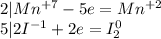
Перемножим коэффициенты:
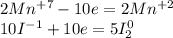
Mn - восстановитель, окисление
I - окислитель, восстановление
Расставим найденные коэффициенты:
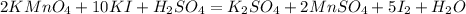
Продолжим уравнивать, слева калия 12, справа лишь 2, коэффициент 6 перед K₂SO₄:
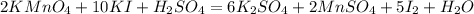
Справа сульфат остатков 8, а слева лишь 1, коэффициент 8 перед H₂SO₄:
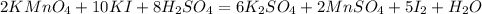
И наконец слева водорода 16, справа 2, коэффициент 8 перед водой:
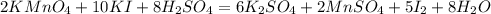
Уравнено!
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Какие степени окисления характерны для металлов II-A группы? Почему...
 плюскваммиперфекти01.02.2022 09:43
плюскваммиперфекти01.02.2022 09:43 -
Какая реакция лежит в основе получения анилина промышленности...
 KNSVAL09.05.2021 07:14
KNSVAL09.05.2021 07:14 -
Пачему раствор сульфат натрия будет нейтральным?...
 mastervydy23.12.2021 23:33
mastervydy23.12.2021 23:33 -
Запишите реакции присоединения водорода, хлора и воды к веществам: А)...
 SaySasha0223.04.2020 08:10
SaySasha0223.04.2020 08:10 -
Укажите вещества, которые можно использовать для проведения опыта «фонтан»...
 МудраяСоваАлександра04.12.2021 03:19
МудраяСоваАлександра04.12.2021 03:19 -
Среди перечисленных солей выберите те, которые гидролизуют: железа (II)...
 Ga1mer30.09.2020 06:06
Ga1mer30.09.2020 06:06 -
Определите валентность элемента в химическом составе элемента: K2O MgO...
 Мирэя22.03.2022 03:32
Мирэя22.03.2022 03:32 -
→ОТМЕЧУ ЛУЧШИЙ ОТВЕТ← 1.FeSO4+H2SO4= 2.FeCl3+NaOH= 3.Fe(OH)2+H2SO4=FeSO4+H2O...
 asovgira16.07.2022 06:39
asovgira16.07.2022 06:39 -
Вычислить массу соли, которая содержится в 500г её 12% растворе....
 ПовелительницаCтихий30.09.2022 03:32
ПовелительницаCтихий30.09.2022 03:32 -
Ставлю 5 звёзд. 8. к сложным веществам относят 1) водород 2) кислород...
 darikesa6924.01.2020 00:59
darikesa6924.01.2020 00:59

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
