Определите массу соли сульфата калия необходимо для получения раствора с массой долей 14% если полученную массу соли растворили в 300 мл воды ответ Приведите с точностью до целых
131
131
Ответы на вопрос:
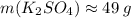
Объяснение:
Дано:
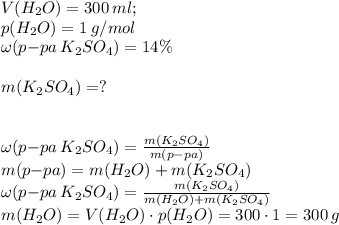
Пусть, х - искомая масса K2SO4.
Получаем:
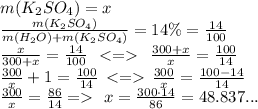
Округляя, в соответствии с условием, до целых, получаем;
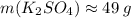
Это и есть ответ:
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Вычислите плотность по воздуху смеси, содержащей 13,44 л (н.у.) пропана...
 mansya0122.05.2020 16:33
mansya0122.05.2020 16:33 -
C+o2= co2 co2 + h2o = h2co3 h2co3+mgo=mgсо3+h2o mgсо3= mgo +co2 mgo...
 Марина3684317.04.2022 00:05
Марина3684317.04.2022 00:05 -
Определите массу ионов серебро в 0,5 л насыщенного растagi...
 нэлли198720.02.2020 11:15
нэлли198720.02.2020 11:15 -
Имеется насыщенный раствор соли . укажите какие изменения произойдут...
 FlexxZ00021.06.2023 19:01
FlexxZ00021.06.2023 19:01 -
Дописать хим.реакции: 1)so2+h2o= 2) so2+na2o= 3)so2+naoh= 4)li2o+h2o=...
 kristinakuleh31.07.2022 00:47
kristinakuleh31.07.2022 00:47 -
Какой спирт надо окислит чтобы получить 2,2 диметилпропаноль ?...
 ника256908.09.2020 00:15
ника256908.09.2020 00:15 -
Приготовить 24г раствора соли с массовой долей 9% . кто решит тому...
 Настя19041130.10.2021 16:48
Настя19041130.10.2021 16:48 -
Осуществить превращения : метан(ch4) оксид углерода (iv) кальция...
 Тёна33310.04.2020 08:14
Тёна33310.04.2020 08:14 -
Переведите в проценты значения массовых долей: а) 0,5 б)0,2 в) 0,11...
 masha20001231556323.03.2020 07:46
masha20001231556323.03.2020 07:46 -
H2o2 в этом оксиде, определите валентности...
 hoivamvrot03.02.2020 01:06
hoivamvrot03.02.2020 01:06

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
