1.Вычислить массу оксида серы (SO2), образовавшегося при взаимодействии 64 граммов серы с кислородом. 2. Определите массу железа, необходимого для получения 43,5 г хлорида железа (III).
3.Рассчитайте массу кислорода, необходимого для образования порции воды массой 9г.
4. Сколько граммов оксида меди (II) образовалось при прокаливании 6,4 г меди.
Ответы на вопрос:
Reply by Kolokokosik
Задача 1:
Дано:
m(S)=64г
Найти:
m(SO2)-?
Решение
Составляем уравнение
64 x
S+O2=SO2
32 32+16*2
64
64x
3264
x=64*64/32=128
ответ:128 г
Задание 2:
Дано:
m(FeCL3)=43.5 g
Найти:
m(Fe)-?
X 43.5 g
2Fe+3CL2-->2FeCL3 M(Fe)=56 g/mol , M(FeCL3)=162.5 g/mol
2*56 2*162.5
X=112*43.5 / 325=14.99 g
ответ 14.99 г
Задание 3:
Дано:
m(H2O)=9г
Найти:
m(O2)-?
Составим пропорцию, воспользовавшись формулой кол-во вещества n=m/М.
2Н2О=2Н2+О2
9х
2*1832
х=32*9/2*18=8 г.
ответ: Масса кислорода, выделившаяся в результате разложения порции воды массой 9 г, равна 8 г.
Задание 4:
Решение на фото =3
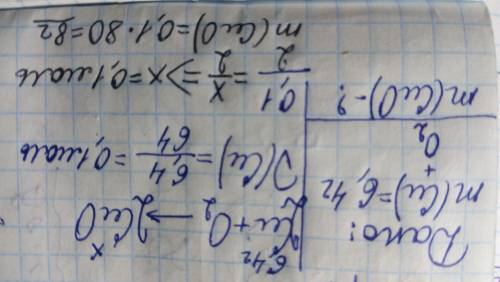
1) лампочка прибора для испытания вещества на электропроводность загорится при погружении электродов в :
3. хлорид натрия (раствор)
2) реакция ионного обмена идёт до конца между веществами
1.гидроксид натрия и хлорид магния
2naoh + mgcl₂ → 2nacl + mg(oh)₂↓
реакция идет до конца, если выпадает осадок.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Формула речовини манган(VІ) оксид манган(ІІ) оксид манган(IV) оксид магній оксид...
 PRPPAPIG200411.09.2022 10:53
PRPPAPIG200411.09.2022 10:53 -
Вкажіть продукт взаємодії калій оксиду з сульфур (VI) оксиду...
 paninadiana1525.01.2020 20:46
paninadiana1525.01.2020 20:46 -
Спо 10 класс дано: m(cnh2n-2)=5,4г д(hcl)-4.48 литров найти: cnh2n-!...
 Арайлым090612.08.2021 15:24
Арайлым090612.08.2021 15:24 -
Які органічні речовини називають оксигеновмісними ? Як їх класифікують?...
 0894f10.06.2023 12:57
0894f10.06.2023 12:57 -
2. Реакция Ar+3Br)= C+д протекает со скоростью 2 молылс) при концентрациях А...
 Nastya2316004.06.2022 18:54
Nastya2316004.06.2022 18:54 -
Закончи уравнение химической реакции взаимодействия фосфора с калием: Если у...
 mrchernuczky69822.04.2023 02:06
mrchernuczky69822.04.2023 02:06 -
ІТЬ БУДЬ ЛАСКА В МЕНЕ КОНТРОЛЬНА Обчислити масу кухонної солі (Na Cl) яку необхідно...
 0606060119.05.2023 14:19
0606060119.05.2023 14:19 -
A box has a volume of 55m3 and a density of 5kgm3. What is the mass of the box?...
 ammaa0918.04.2023 07:04
ammaa0918.04.2023 07:04 -
Закон Авогадро. Молярный объем В лаборатории находятся одинаковые по объему и...
 annattarsova030.12.2021 03:38
annattarsova030.12.2021 03:38 -
Формула HCI ;М г/моль-?; n( моль) -? ; м(г) -? ;v(л) -? ;N( молекул) 6*10 в 21...
 ulia0920041324.08.2021 22:52
ulia0920041324.08.2021 22:52

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
