Уравнения химических реакций взаимодействия водорода в каком случае Н2 стоит перед металлом, а в какой после?
Ответы на вопрос:
7.32% HCl; 143 г Воды; 5% KCl
Объяснение:
1) 2K + 2H2O = 2KOH + H2
m(K)= 5.85г
n(K) = 5.85÷39 = 0.15 моль
m(KOH) = 0.15 × 56 = 8.4г
m(H2O) = 18×0.15= 2.7 г
Калий и гидроксид калия относятся друг к другу 1 к 1. Значит гидроксида калия образовалось тоже 0.15 моль
2)KOH + HCl = KCl + H2O
n(KOH) = 0.15
Гидроксид калия и соляная кислота относятся друг к другу как 1 к 1, значит соляная кислота была использована кол-вом 0.15 моль
n(HCl) = 0.15 моль
m(HCl) = 0.15 × 36.5 = 5.475 грамм
w%(р-ра) =
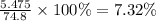
Массовая доля HCl в растворе была 7.32% (ответ 2)
3) Масса раствора после нейтрализации 223.5 г
Если мы отнимем массу раствора соляной кислоты от итоговой массы раствора: 223.5 - 74.8 = 148.7 это масса первого раствора KOH и вода, так как она была в избытке.
148.7 - 8.4 + 2.7 = 143 г Воды (ответ 3)
148.7 - масса первого раствора
8.4 масса KOH
2.7 масса воды, которая вступила в реакцию
4) n(KCl) = 0.15
m(KCl) = 11.175
m(р-ра) = 223.5
w%(р-ра)=
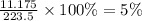
ответ: 5%
Если будут вопросы , отвечу с удовольствием в комментариях.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
С.через пол часа задавать тетрадь...
 Проgh22.07.2022 21:43
Проgh22.07.2022 21:43 -
90 ! доклад по на тему ,,моё любимое вещество,, . нужна работа примерно на 1-2...
 ladykati05.06.2023 08:23
ladykati05.06.2023 08:23 -
Решите . определите массу 6% раствора соляной кислоты, затраченного на взаимодействие...
 AlisaSerikh25.05.2022 16:43
AlisaSerikh25.05.2022 16:43 -
С. заранее . 1 лист только верхнее под буквой в, остальное название веществ по...
 BrusLee2208.04.2021 01:16
BrusLee2208.04.2021 01:16 -
Составьте структурные формулы 3-метилпентин-1...
 aselimsovetova25.03.2020 00:10
aselimsovetova25.03.2020 00:10 -
Решить цепочку по неорганической прошу надо как можно скорее...
 Vladttttt04.01.2022 05:30
Vladttttt04.01.2022 05:30 -
5закинчить ривняння можливих реакций...
 dhgdfnhflk12.11.2021 01:01
dhgdfnhflk12.11.2021 01:01 -
Яка з наведених формула лугу: zn(oh)2,cr(oh) 2,cute(oh) 2,кон...
 Igor68121.04.2023 15:49
Igor68121.04.2023 15:49 -
4).Какая масса азота участвовала в реакции N2+3H2=2NH3+92 кДж, если при этом...
 maks72216.10.2020 10:22
maks72216.10.2020 10:22 -
При каком заболевании нельзя давать сосудорасширяющие препараты до приезда врачей?...
 nOMOshHuK228.04.2023 19:22
nOMOshHuK228.04.2023 19:22

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
