Молярный коэффициент поглощения KМnO4 при λ = 546 нм равен 2420. Оптическая плотность исследуемого раствора в кювете толщиной слоя 2 см равна 0,80. Чему равен Т(KМnO4), г/см3?
231
500
Ответы на вопрос:
Привет!
Информация из задачи:
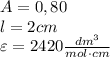
искал:
Решение задачи:
Используя закон Ламберта-Беeра, я рассчитываю концентрацию раствора KMnO₄: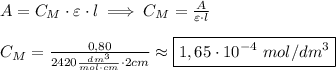
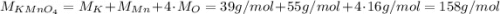
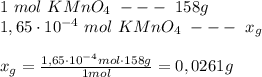
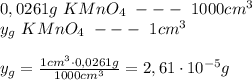
следовательно: 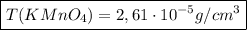
Извините, я не знаю русский.
49 г хг
cu(oh)2 ==t== cuo + h2o
98 г/моль 80 г/моль
рассчитаем молярную массу гидроксида и оксида меди:
- гидроксид меди - 64 + (16 + 1) * 2 = 98 г/моль;
- оксид меди - 64 + 16 = 80 г/моль.
составим пропорцию:
хг - 49г
80г/моль - 98г/моль.
решим пропорцию:
х = (80 * 49) / 98 = 40гр.
ответ: масса оксида меди (ii),образующегося при разложении 49 гр гидроксида меди (ii), равна 40 гр.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Определите вид связи и запешите схему образования для веществ с...
 SashylikS17.02.2022 23:58
SashylikS17.02.2022 23:58 -
ГУМАНИТАРИЮ! 1) Укажите, в какой последовательности увеличивается...
 2112200716.02.2020 12:31
2112200716.02.2020 12:31 -
Распределите валентные электроны по квантовым ячейкам в возбужденном...
 лялялятраляляля105.08.2021 09:04
лялялятраляляля105.08.2021 09:04 -
с химией, очень нужно 1) Напишите структурные формулы веществ:...
 Ha4uk19.03.2020 07:22
Ha4uk19.03.2020 07:22 -
Какие вещества всегда в движении...
 timkazhimov01.08.2021 23:38
timkazhimov01.08.2021 23:38 -
У склянках без етикеток знаходяться такі речовини: сухі аргентум...
 Скажи201825.01.2023 07:41
Скажи201825.01.2023 07:41 -
с химией 1. Разбавленная соляная кислота не реагирует ни с одним...
 Даше4ка1612.06.2020 22:19
Даше4ка1612.06.2020 22:19 -
7. В двух одинаковых склянках без этикеток находятся бесцветные...
 MCKiri4PrO26.11.2022 20:45
MCKiri4PrO26.11.2022 20:45 -
Какой объем кислорода и воздуха потребуется для сжигания 57, 2...
 ОдУвАнЧиК0725.07.2021 07:03
ОдУвАнЧиК0725.07.2021 07:03 -
Составьте уравнения реакций в молекулярном, полном и кратком ионных...
 sergio2014p06q4e25.04.2022 02:59
sergio2014p06q4e25.04.2022 02:59

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
