рассчитайте массу гидроксида калия израсходованного для нейтрализации серной кислоты если в результате реакции образовался сульфат калия массой 13,552г с практическим выхожом равным 79%
Ответы на вопрос:
7994 грамма
Объяснение:
Известен тип реакции(обмена) основания и ангидрида:
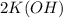 +
+ 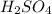 =
= 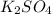 +
+ 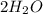
Если раствор сульфата калия и воды это 100% то вычитая из массы раствора массу серной кислоты можно получить процент содержания основания в реагентах.
Вычислить процент серной кислоты в составе реагентов так как по закону сохранения масс веществ реакция не меняет числовые значения содержания атомов элементов в растворе.
Процент вещества в составе смеси реагентов вычисляется сравнения относительной молекулярной массы нужного соединения с суммой масс веществ всего раствора:
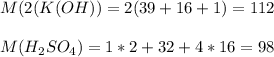
112+98 = 210 дальтон => 98:210*100 = 46,(6) % - процент массы кислоты
значит процент основания от общей массы 53.4%
Процент воды в растворе продуктов 21%
21/79 = 0.26 => 0.26* 13552 = 3602.4 г -масса воды в растворе
13552 + 3602.4 = 17154,4г масса всего раствора продуктов
53.4 / 100 * 17154.4г = 9160,4 г - масса серной кислоты в реагентах
Следовательно:
17154.4г - 9160,4 = 7994 грамма гидроксида калия было израсходовано
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
ребята я вас очень сильно я не понимаю как это делать...
 Naati14pr04.02.2020 08:17
Naati14pr04.02.2020 08:17 -
химия 11 класс ребят 252 и 254...
 132623741641416.02.2022 10:16
132623741641416.02.2022 10:16 -
Написать уравнения реакций, указать типы реакций: Ca SO₄ → Ca (OH)₂ → Ca Cl₂...
 Лолери07.02.2023 06:28
Лолери07.02.2023 06:28 -
Складіть формули основ утворених металами : Mg, Cu(l), Al...
 Polinaaa1430.09.2022 10:25
Polinaaa1430.09.2022 10:25 -
Здійсніть перетворення P→P2O5→H3PO4→PO4 Можна ЩОБ ШВИДШЕ РОЗВЯЗАЛИ БУДЬЛАСКА...
 wigler19.03.2021 18:05
wigler19.03.2021 18:05 -
1)В последовательности химических элементов ,,,,,, кислотные свойства высших...
 Айсара77706.07.2022 23:32
Айсара77706.07.2022 23:32 -
НАРОД ХОТЬ ОДНО ЗАДАНИЕ (8класс)...
 alexeyvinogradp0do9x20.06.2021 02:37
alexeyvinogradp0do9x20.06.2021 02:37 -
Масова частка Оксигену в хімічній сполуці елемента шостої групи складає 60...
 алла778130.07.2021 21:41
алла778130.07.2021 21:41 -
В последовательности химических элементов ,,,,,, кислотные свойства высших...
 Sasha774918.04.2023 02:25
Sasha774918.04.2023 02:25 -
Решите контрольную по химии(сколько сможете)завтра сдавать ((((...
 gunggunggung03.01.2021 06:10
gunggunggung03.01.2021 06:10

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
