Какой объем раствора азотной кислоты (пл. 1,18) с массовой долей HNO3 30% будет израсходован на растворение сплава массой 10г, состоящего из меди (массовая доля 60%) и серебра (40%)?
272
299
Ответы на вопрос:
15.045 мл
Объяснение:
Из условия видно, что меди в сплаве 6 г, а серебра 4 г.
Составим пропорцию для расчета массы азотной кислоты при взаимодействии с медью
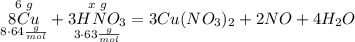
Считаем массу кислоты
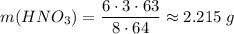
Составим пропорцию для расчета массы азотной кислоты при взаимодействии с серебром
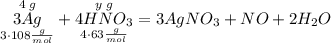
Считаем массу кислоты
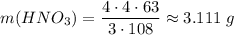
Общая масса кислоты 2.215 + 3.111 = 5.326 г
Считаем массу раствора
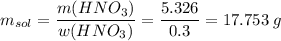
Считаем объем раствора кислоты
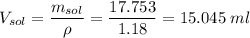
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Является однородной смесью глина с водой...
 Exem7613.05.2023 00:47
Exem7613.05.2023 00:47 -
ЗАДАНИЕ 2 , Даны вещества. Определите вид химической связи для каждого...
 Sonyamay18.12.2022 03:26
Sonyamay18.12.2022 03:26 -
Вставьте пропущенные слова в предложения. 1. Столовый уксус представляет...
 eva7021812.11.2020 14:29
eva7021812.11.2020 14:29 -
Определите силу электролита, если при диссоциации 80 молекул продиссоциировало...
 девочкаксюша10.08.2020 01:53
девочкаксюша10.08.2020 01:53 -
Өте мықты емес химиялық байланыс...
 Даниил535606.03.2020 17:24
Даниил535606.03.2020 17:24 -
Аллтерация не мақсатта қойылады...
 ИрэнУолтен15.03.2022 09:33
ИрэнУолтен15.03.2022 09:33 -
Составьте таблицу в стиле диаграмма Венна Даны два произведения Первое...
 Диана96666618.05.2020 02:47
Диана96666618.05.2020 02:47 -
Навеска металла массой 0.350г вытеснила из кислоты 209 мл водорода при...
 2005SuperMax200506.04.2020 23:12
2005SuperMax200506.04.2020 23:12 -
Что такое ион гидроксония и как он образуется?...
 nitkind06.01.2020 18:11
nitkind06.01.2020 18:11 -
Составьте уравнение реакции, соответствующей схеме s0 - s-2 укажите окислитель...
 novakelizaveta7105.09.2021 05:15
novakelizaveta7105.09.2021 05:15

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
