Вычислите время, необходимое для выделения железа массой 2,8 г из раствора сульфата железа (II) силой тока в 10 А.
Ответы на вопрос:
Дано:
m(Fe) = 2,8 гр
I = 10 А
Найти:
t - ?
1) Для начала мы запишем формулу про закон Фарадея про нахождения массы, потом напишем формулу про нахождения времени необходимого для выделения железа:
m = (M×I×t)/(n×F) ⇒ t = (m(Fe)×n×F)/(M(Fe)×I) (1)
2) Далее напишем для выделения железа из раствора FeSO₄, чтобы узнать сколько количество n (n - число электронов, участвующих в процессе окисления-восстановления):
FeSO₄ → Fe²⁺ + SO₄²⁻
Kt⁻ : Fe²⁺ + 2e⁻ → Fe⁰ | 2 | | | |
2H₂O + 2e⁻ → H₂↑ + 2OH⁻ | 2 | 4 | | 1 |
An⁺ : SO₄²⁻ - не окисляется | | | 4 | |
2H₂O - 4e⁻ → O₂↑ + 4H⁺ | 4 | 4 | | 1 |
Следовательно:
Fe²⁺ + SO²⁻ + 2H₂O + 2H₂O → Fe⁰ + H₂↑ + 2OH⁻ + O₂↑ + 4H⁺ + SO₄²⁻
FeSO₄ + 4H₂O (ПЭТ) → Fe + H₂↑ + 2H₂O + O₂↑ + H₂SO₄
FeSO₄ + 2H₂O (ПЭТ) → Fe + H₂↑ + O₂↑ + H₂SO₄
3) Теперь из электролиза мы узнали что число электронов, участвующих в процессе окисления-восстановления у железа равен 2 ⇒ n = 2
4) Теперь находим время необходимое для выделения железа из формулы (1):
M(Fe) = 56 гр/моль
t = (m(Fe)×n×F)/(M(Fe)×I) = (2,8 гр × 2 × 96500 Кл)/((56 гр/моль × 10 А) = (0,05 моль × 2 × 96500 (А×с))/10 А = 0,1 × 9650 сек = 965 сек ≈ 16,08 мин
ответ: t = 16,08 мин
Решено от : 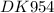
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
1. Какое количество -связей образует каждый атом углерода в молекуле...
 HesteVlad31.03.2020 03:25
HesteVlad31.03.2020 03:25 -
предложенного перечня выберите две реакции которому относится взаимодействие...
 lobster3224.01.2022 11:40
lobster3224.01.2022 11:40 -
1. Определите электронную формулу, соответствующую иону Al±³ А) 1s²2s²2p⁶3s²3p⁶...
 namdokp09srw11.10.2022 04:54
namdokp09srw11.10.2022 04:54 -
Как получить из: Mg》MgO》MgCl2 》Mg(OH)³...
 lavrovaa003.02.2021 17:05
lavrovaa003.02.2021 17:05 -
Каким образом можно получить такие соединения натрия: -пероксид -гидроксид...
 AnnieFire114.02.2020 07:06
AnnieFire114.02.2020 07:06 -
3. Позначте хімічний символ і формулу водневої сполуки елемента з...
 Евгения6554528.05.2023 19:42
Евгения6554528.05.2023 19:42 -
В якій парі обидва хімічні елементи мають на зовнішньому енергетичному...
 ghujftu09.07.2021 20:44
ghujftu09.07.2021 20:44 -
Решить 4 тестовых заданий по химии...
 Нуб000112.12.2020 20:05
Нуб000112.12.2020 20:05 -
Из ацетилена объемом 44.8л. по реакции Кучерова с выходом 90% получил...
 Nessmikk1303.04.2022 05:35
Nessmikk1303.04.2022 05:35 -
ТЕКСТ ЗАДАНИЯ Жиры являются сложными органическими соединениями, которые...
 Лина783916.06.2023 07:29
Лина783916.06.2023 07:29

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
