Для окислительно-восстановительной реакции, уравнение которой KMnO4+KI+H2SO4→MnSO4+K2SO4+I2+H2O привести схему электронного баланса, расставить коэффициенты в уравнении, определить окислитель и восстановитель.
128
270
Ответы на вопрос:
2 KMnO4 + 10 KI + 8 H2SO4 → 2 MnSO4 + 6 K2SO4 + 5 I2 + 8 H2O
2 Mn(VII) + 10 e- → 2 Mn(II)
(восстановле́ние)
10 I(-I) - 10 e- → 10 I(0)
(окисление)
KMnO4 является окислителем, KI является восстановителем.
2 Mn(VII) + 10 e- → 2 Mn(II)
(восстановле́ние)
10 I(-I) - 10 e- → 10 I(0)
(окисление)
KMnO4 является окислителем, KI является восстановителем.
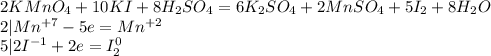
Объяснение:
Запишем уравнение:
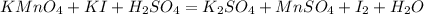
Расставим степени окисление и оставим их только у тех кто меняет их:
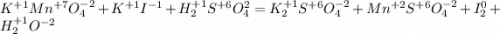
Останется:
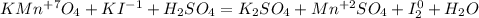
Запишем ОВР редокс для марганца и йода:
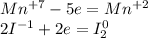
Перед йодом коэффициент 2, так как справа уже есть 2 йода, уравняем электроны:
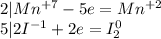
Перемножим коэффициенты:
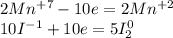
Mn - восстановитель, окисление
I - окислитель, восстановление
Расставим найденные коэффициенты:
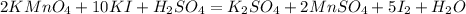
Продолжим уравнивать, слева калия 12, справа лишь 2, коэффициент 6 перед K₂SO₄:
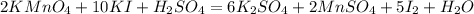
Справа сульфат остатков 8, а слева лишь 1, коэффициент 8 перед H₂SO₄:
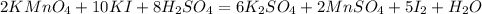
И наконец слева водорода 16, справа 2, коэффициент 8 перед водой:
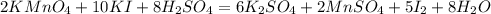
Уравнено!
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
X+koh(раствор) =пропанон x-?...
 drrrrrr202.08.2022 09:51
drrrrrr202.08.2022 09:51 -
Красный порошок меди (6,4 г) смешали с желтым порошком серы (3,2...
 Yasmina5510.08.2022 02:25
Yasmina5510.08.2022 02:25 -
Суретке қай реакция теңдеуі сәйкес келеді?...
 EkaterinaVNTOGLIATTI23.05.2021 21:28
EkaterinaVNTOGLIATTI23.05.2021 21:28 -
Царица клеопатра по совету придворного медика растворила в уксусе...
 Viktoria1234567890125.11.2020 10:02
Viktoria1234567890125.11.2020 10:02 -
Напишите формулы оксидов, гидратами которых являются следущие кислоты:...
 kristinakissa126.09.2021 12:22
kristinakissa126.09.2021 12:22 -
Визначте формулу вторинного аміну масові частки атомарних карбону,...
 artemkafire200512.02.2021 23:15
artemkafire200512.02.2021 23:15 -
Что такое углеродная цепь? как построить формулу углеводорода?...
 Superniolay01.10.2022 03:04
Superniolay01.10.2022 03:04 -
При сжигании 2,24 л углеводорода получили 13,2 г оксида углерода...
 кэм12115.06.2020 14:02
кэм12115.06.2020 14:02 -
Вкажіть процеси які проходять із руйнуванням ароматичної системи...
 nastya271901.05.2021 17:17
nastya271901.05.2021 17:17 -
Определите расход (в кг) гидроксида натрия и кальцинированной соды...
 alisapogorlyakoz2epw24.04.2023 04:34
alisapogorlyakoz2epw24.04.2023 04:34

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
