Ответы на вопрос:
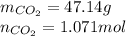
Объяснение:
Чтобы найти количество вещества газа нужно разделить объем газа на молярный объем
Молярный объем - объем занимаемый одним молем наза при данных условиях, при нормальных условиях он всегда равен 22.4 литра на моль, для любого газа
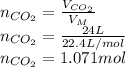
Количество вещества это также отношение массы к молярной массе, то есть массе одного моля:
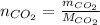
Мы можем приравнять количество вещества через объем и массы и выразить массу:
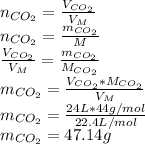
Найти молярную массу можно используя таблицу Менделеева, сложив массы каждого из веществ входящих в молекулу, то есть
CO₂ - это один C и два O
C = 12 г / моль
O = 16 г / моль
M = 12 + 16 + 16 = 44 г/моль
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
1. Обчисліть молярну масу сульфур(ІV) оксиду: а) 32г/моль; б) 64...
 MrEvgeniy127.06.2021 03:06
MrEvgeniy127.06.2021 03:06 -
Укажіть кількість речовини та молекул у 2 моль води...
 Motornerplay11.08.2020 17:13
Motornerplay11.08.2020 17:13 -
решить газ масою 2г за нормальних умов займає об єм 11.2 який об...
 mikstura7105.10.2021 10:46
mikstura7105.10.2021 10:46 -
Вычислить массу осадка, образующегося при реакции 320грамм 10% раствора...
 araitokbasova24.09.2020 12:42
araitokbasova24.09.2020 12:42 -
Реагирует ли фенол с водой? Если да, то как?...
 rodoskinatanya16.06.2021 00:37
rodoskinatanya16.06.2021 00:37 -
Нужна Ничего в этом не понимаю)...
 Barbara726413.05.2023 05:05
Barbara726413.05.2023 05:05 -
Дайте відповідь на 3 запитання: 1.за до якої функції гемоглобін...
 vano139924.10.2022 06:32
vano139924.10.2022 06:32 -
Обчисліть масову частку натрій хлориду врозчині виготовленому розчиненням...
 0динокийхомяк30.03.2023 01:49
0динокийхомяк30.03.2023 01:49 -
Резервуар объемом 50 м3 вмещает 25 т жидкого аммиака NH3. Во сколько...
 GDA118.04.2021 20:01
GDA118.04.2021 20:01 -
1) В баллоне находится 850 г аммиака. Какой объем (н.у.) займет это...
 ykropmen22.07.2021 22:54
ykropmen22.07.2021 22:54

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
