Рассчитай формулу кристаллогидрата сульфита натрия, зная, что массовая доля безводного вещества в нём составляет 50 %.
124
278
Ответы на вопрос:
Na₂SO₃ * 7H₂O
Объяснение:
Na₂SO₃ * nH₂O
M(Na₂SO₃) = 126г/моль
так как массовая доля безводного вещества составляет 50 %, то
М(nH₂O) = 126г/моль
n = 126г/моль/ 18г/моль = 7
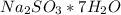
Объяснение:
Общая формула кристаллогидрата сульфита натрия:
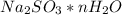
Массовая доля 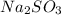 (сухой соли) во всем кристаллогидрате
(сухой соли) во всем кристаллогидрате 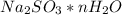 равна 50% (0.5), составим уравнение, взяв за x количество молекул воды:
равна 50% (0.5), составим уравнение, взяв за x количество молекул воды:
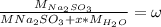
Выразим отсюда x с математических преобразований и получим:
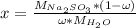
Подставим значения:
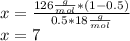
Запишем формулу кристаллогидрата:
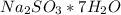 - гептагидрат сульфита натрия
- гептагидрат сульфита натрия
※Математические преобразования:
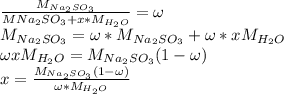
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Sio2-- si-- sio2-- na2sio3-- h2sio3-- sio2...
 cvacvadav24.01.2022 23:13
cvacvadav24.01.2022 23:13 -
Раставные коэффиценты fe+h2so4 fe2(so4)3+so2+h2oв...
 zora319.03.2023 15:03
zora319.03.2023 15:03 -
Вычислите массу меди которая выделится при взаимодействии алюминия...
 daulrtutegenov128.03.2023 10:00
daulrtutegenov128.03.2023 10:00 -
Складить молекулярни ривняння, що таким йонно-молекулярним ривнянням...
 mishasinik29.04.2022 07:07
mishasinik29.04.2022 07:07 -
Определите сколько медного купороса выпало при охлаждении до...
 sakhnovavaleri129.10.2020 01:50
sakhnovavaleri129.10.2020 01:50 -
Найдите массу воды и объем углекислого газа (н. образующихся...
 Ника8552724.08.2022 08:28
Ника8552724.08.2022 08:28 -
Составьте уравнения реакции s- so2- so3- h2so4...
 Ученик109023014710.09.2020 20:02
Ученик109023014710.09.2020 20:02 -
При горении серы в кислороде образуется оксид серы (4) верно...
 MaxDeep16.10.2022 12:11
MaxDeep16.10.2022 12:11 -
Скільки молів сульфатної кислоти H2Sо2 можна одержати з 15.05...
 Dgj810.09.2021 23:48
Dgj810.09.2021 23:48 -
по химии! Напишите МОЛЕКУЛЯРНОЕ СОЕДИНЕНИЕ химической(ого) реакции...
 Dave99909.04.2022 23:14
Dave99909.04.2022 23:14

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.

