Ответы на вопрос:
686 г
Объяснение:
P2O5+3H2O=2H3PO4
m(P2O5)=500 г
М(P2O5)=142 г/моль
v(P2O5)=500/142=3,5 моль
Пусть v(H3PO4)=x моль, тогда составим пропорцию
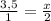
х=7 моль
М(H3PO4)=98 г/моль
m(H3PO4)=7*98=686 г
m(H3PO4) = 686 г
Объяснение:
Дано :
m(P2O5) = 500 u
Найти :
m(H3PO4) - ?
P2O5+3H2O → 2H3PO4
1)n(P2O5) = m/M
M(P2O5) = 31*2+16*5 = 142 г/моль
n(P2O5) = 500 г/142 г/моль = 3,5 моль
n(P2O5) = 3,5 моль
3,5 моль n(H3PO4)
= =>
1 2
n(H3PO4) = 3,5 моль * 2 = 7 моль
n(H3PO4) = 7 моль
3) m(H3PO4) = n*M
M(H3PO4) = 1*3+31+16*4 = 98 г/моль
m(H3PO4) = 7 моль * 98 г/моль = 686 г
m(H3PO4) = 686 г
ответ : m(H3PO4) = 686 г
1) v экв. o2 (2 2-хвал-х атома в мол-е) = 22.4/(2*2) = 5.6 л; 2) по з. эквив-в, м экв. ме = 4*(5.6/1.4) = 16 г/моль (либо это титан ti (м = 48 г/моль = 16*3) в оксиде ti2o3, что маловероятно, т.к. при окислении титана o2 образ-ся tio2, либо это молибден mo (м = 96 г/моль = 16*6) в оксиде moo3).
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Вычислить массу: 1) 150 моль натриевной селитры (nano3) 2) 235,5 моль...
 Fantik14rus07.01.2021 18:40
Fantik14rus07.01.2021 18:40 -
Вычислить количество атомов : 1) порции железа количеством вещества 10...
 никнэйм014.04.2020 13:36
никнэйм014.04.2020 13:36 -
Fe+ fecl2+h2 расставить коэфиициенты и указать тип реакции...
 Freidan25.05.2023 00:28
Freidan25.05.2023 00:28 -
Al(oh) al2o3+h2o расставить коэфициенты и указать тип реакции...
 umeson05.03.2021 10:00
umeson05.03.2021 10:00 -
Врезультате сжигания 9,76 г органического вещества в избытке кислорода...
 НастяПи12.11.2020 09:39
НастяПи12.11.2020 09:39 -
Порция серы содержит 60 *10 в степени 23 атомов серы.какому количеству...
 Alexgk1323.02.2023 06:16
Alexgk1323.02.2023 06:16 -
Какова масса 6,5 молькремния? сколько атомов кремния содержится в этой...
 karyakinayulya08.07.2020 23:54
karyakinayulya08.07.2020 23:54 -
Три возможных изомера для веществ c4h8...
 мустафа1529.06.2021 13:09
мустафа1529.06.2021 13:09 -
2na(so4)+bacl2 2nacl+ba2(so4)2 в ионной форме...
 9petya23.12.2022 12:49
9petya23.12.2022 12:49 -
Составить уравнение в молекулярной и ионной форме h2s + kmno4 + h2so4...
 alicahirdeeva13.08.2020 08:24
alicahirdeeva13.08.2020 08:24

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
