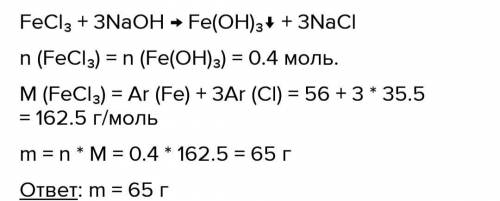Рассчитайте массу хлорида железа (III), при взаимодействии которого с гидроксидом натрия получится гидроксид железа(ІІ) химическим количеством 0,4 моль
Ответы на вопрос:
1. m (mgo) = 8 г
m р-ра (hn03) = 157.5 г
w (hno3) = 20% = 0.2
m соли - ?
mgo + 2hno3 = mg(no3)2 + h20
m (hno3) = 157.5*0.2 = 31.5 г
n (hno3)= 31.5/63 = 0.5 моль (избыток)
n (mgo) = 8/40 = 0.2 моль (недостаток)
расчет ведем по недостатку
n (mgo) = n (mg(no3)2) = 0.2 моль
m (mg(no3)2) = 0.2*148= 29.6 грамм
2. m (mgo) = 8 г
m р-ра (hcl) = 146 г
w (hcl) = 20% = 0.2
m соли - ?
w соли - ?
mgo + 2hcl = mgcl2 + h2o
m (hcl) = 146*0.2 = 29.2 грамма
n (hcl) = 29.2/36.5 = 0.8 моль (избыток)
n (mgo) = 8/40 = 0.2 моль (недостаток)
расчет ведем по недостатку
n (mgo) = n (mgcl2) = 0.2 моль
m (mgcl2) = 0.2*95 = 19 грамм
3. m (mgo) = 40 г
m р-ра (h2so4) = 196 г
w (h2so4) = 10% = 0.1
m осадка = ?
mgo + h2so4 = mgso4 + h2o
m (h2so4) = 196*0.1 = 19.6 грамм
n (h2so4) = 19.6/98 = 0.2 моль (недостаток)
n (mgo) = 40/40 = 1 моль (избыток)
расчет ведем по недостатку
n (h2so4) = n (mgso4) = 0.2 моль
m (mgso4) = 0.2*120 = 24 грамма
4. m р-ра (naoh) = 80 г
w (naoh) = 10% = 0.1
m р-ра (cuso4) = 80 г
w (cuso4) = 40% = 0.4
m осадка - ?
w соли - ?
2naoh + cuso4 = cu(oh)2 + na2so4
m (naoh) = 80*0.1 = 8 г
n (naoh) = 8/40 = 0.2 моль
m (cuso4) = 80*0.4 = 32 г
n (cuso4) = 32/160 = 0.2 моль
n (naoh) = n (cu(oh)2) = 0.2/2 = 0.1
m (cu(oh)2) = 0.1*97 = 9.7 грамма
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Опишите невозобновляемые природные ресурсы. Почему их так назвали?...
 lol663321.06.2023 20:23
lol663321.06.2023 20:23 -
Сүйектің негізгі құрамына кіретін элементті табыңыз A)He B)Fe C)Ca...
 Sagidanovadi12.05.2020 23:01
Sagidanovadi12.05.2020 23:01 -
Составьте формулы веществ: силикат калия, оксид азота (V), плавиковая...
 Olegg930.06.2021 08:42
Olegg930.06.2021 08:42 -
Масса сложного эфира, полученного из 15 гр уксусной кислоты и 20...
 kucherenkolshaLexa12.04.2021 21:38
kucherenkolshaLexa12.04.2021 21:38 -
Яку масу води слід додати до 300г розчину оцтової кислоти з масовою...
 AndreiBrazhnikov130.03.2023 04:39
AndreiBrazhnikov130.03.2023 04:39 -
Поясніть яка речовина важча: cuso4, h2so4, h2o...
 zemairen07.10.2021 21:52
zemairen07.10.2021 21:52 -
складить ривняння реакции за до яких можна здийснити таки перетворення...
 anisimovamargar103.06.2020 08:08
anisimovamargar103.06.2020 08:08 -
Складіть рівняння можливих реакцій мiж купрум (II) хлоридом та...
 lerak130120.06.2021 03:22
lerak130120.06.2021 03:22 -
40 г смеси оксидов кальция и магния растворили в соляной кислоте,...
 eva44478621.01.2023 02:59
eva44478621.01.2023 02:59 -
4. У якому рядку наведено сполуки з ковалентним неполярним типом...
 lozhe4ka14.11.2021 18:33
lozhe4ka14.11.2021 18:33

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.