Рассчитай формулу соединения, зная, что в состав вещества входит элемент марганец (его массовая доля составляет 53,4 %) и элемент кислород.
Ответы на вопрос:
Дано:
ω(Mn) = 53,4%
ω(O) = 46,6%
Найти:
MnₓO
Найдем соотношение атомов марганца и кислорода:
x : y = 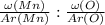 =
=  = 0,97 : 2,9125
= 0,97 : 2,9125
Чтобы перейти к соотношению целых чисел выбираем меньшее число из всех и оба числа делим на него:
x : y = 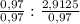 = 1 : 3
= 1 : 3
MnO₃
ответ: MnO₃разбавленная серная кислота проявляет все свойства кислот, т. е. -взаимодействует с металлов ( с feo)- с образованием соли сульфата железа 2 и воды) ; (диоксид серы- это оксид неметалла, следовательно в реакцию не вступает с разбавленной серной кислотой)
h2so4+> feso4+h2o
2h(+) + so4(-2) +> fe(+2)+so4(-2) + h2o
-с вступает в реакцию нейтрализации (с cu(oh)2) образует соль- сульфат меди и воду;
h2so4+cu(oh)> cuso4+2h2o
2h(+) + so4(-2) +cu(oh)> cu(+2)+so4(-2) +2h2o
-с растворимыми в воде солями (с bacl2) - образуется сульфат бария (в осадок выпадет) и хлор-водород hcl.
h2so4+> baso4+2hcl
2h(+)+so4(-2)+ba(+2)+> 2h(+)++baso4
- c металлами, стоящими в ряду напряжения до водорода. (медь стоит после водорода, следовательно, в реакцию с разбавленной серной кислотой не вступает
вопрос: нельзя что-ли загуглить?
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Какой объем o2 необходим для полного сгорания 0.25 грамм этилена, содержащего 15%...
 Сэээээ28.05.2023 22:55
Сэээээ28.05.2023 22:55 -
Что такое свойство вещества. примеры...
 veraveta23.06.2020 01:13
veraveta23.06.2020 01:13 -
Дано: zncl2 найти w(zn) - ? w (cl) - ? 34...
 SevenDays727.04.2021 10:10
SevenDays727.04.2021 10:10 -
1. из перечня надо выписать отдельно названия веществ и предметов ( тел): железо,...
 Zelikovakasimov27.07.2021 19:33
Zelikovakasimov27.07.2021 19:33 -
Написать уравнения горения в кислороде всех элементов 5-го периода...
 yrarissikhin07.04.2021 16:21
yrarissikhin07.04.2021 16:21 -
Какие выражения верны? 1самая высокая электроотрицательность у фтора 2самый электроотрицательный...
 xotabich2115.12.2022 16:02
xotabich2115.12.2022 16:02 -
Уравнять реакции (в молекулярной есть, в полной и сокращённой ионной формах) 1)...
 mavikon16.11.2020 11:01
mavikon16.11.2020 11:01 -
Метан содержит равное количество атомов с 56 л аммиаком. найдите разницу объемов...
 OWERpass11.06.2021 05:18
OWERpass11.06.2021 05:18 -
Сумма коэффицентов в реакции взаимодействия избытка концентрированой серной кислоты...
 ledilove7710.10.2021 22:15
ledilove7710.10.2021 22:15 -
Хлорид железа(iv) + серная кислота=...
 1425171429.07.2020 14:16
1425171429.07.2020 14:16

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
