кто нибудь объясните мне по химии. fe+cl2=fecl3. Откуда взялась три хлора, если было два скажитеее
Ответы на вопрос:
Уравнение не уравнено, поэтому и возникает подобный вопрос, надо его уравнять:
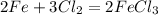
Теперь все верно: было 6 хлора и осталось 6 хлора
Уравнивать можно подбором, как тут, по ОВР, по ионным реакциям
Железо может проявлять валентность II или III, то есть при взаимодействии с неметаллами отдает 2 или 3 электрона.
Хлор при взаимодействии с металлами проявляет валентность I (он имеет 7 валентных электронов, до завершения внешнего электронного уровня не хватает 1 электрона). Хлор принимает 1 электрон от другого элемента.
Хлор является сильным окислителем, поэтому в реакции с ним железо отдает 3 электрона, то есть проявляет валентность III.
С учетом валентностей железа и хлора формула хлорида железа (III) имеет вид: FeCl₃.
Учитываем закон сохранения массы веществ в химических реакциях: масса веществ, вступивших в реакцию равна массе полученных веществ.
Уравнение реакции нужно уравнять, что выполнялся закон сохранения массы веществ.
2Fe + 3Cl₂ = 2FeCl₃
pH=9,52
Объяснение:
Сначала следует записать разложение гидроксида на ионы:
⇄
Теперь запишем произведение растворимости:
ПР
Из уравнения реакции видно, что получается, что
Отсюда можно найти рОН
рН связан с рОН следующим образом:
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Определите, какие из перечисленных ниже солей подвергаются гидролизу: 〖NaNO〗_3;...
 Темирлан200302.04.2023 15:04
Темирлан200302.04.2023 15:04 -
Фосфат калия + нитрат бария...
 PtichkaSchelkoi15.04.2022 17:07
PtichkaSchelkoi15.04.2022 17:07 -
10 класс Химия с тестом (я не понимаю, что это за пентаграмма...
 лёха192002.08.2021 20:44
лёха192002.08.2021 20:44 -
При відновленні нітробензену масою 250 г одержали анілін масою 150 г . Обчисліть...
 trixi1989vv27.04.2022 15:26
trixi1989vv27.04.2022 15:26 -
Обчислити об єм водню за нормальних умов,що виділяють в результаті взаємодії...
 mariaponomarev119.02.2020 02:46
mariaponomarev119.02.2020 02:46 -
2. Известно, что кислоты могут взаимодействовать с металлами. напишите не...
 liza136723.11.2021 10:03
liza136723.11.2021 10:03 -
Реакция уравнение, которой представлена ниже, является реакцией N2 + 3H2 =...
 AVlone05.05.2023 07:09
AVlone05.05.2023 07:09 -
Виконати перетворення, написавши рівняння реакцій. Урівняти. Цинк_ цинку оксид_...
 kovtunvadym31.05.2022 00:20
kovtunvadym31.05.2022 00:20 -
Решите задание по химии , которое на фотографии!!!...
 Zagitova11214.05.2023 14:07
Zagitova11214.05.2023 14:07 -
На 17 апреля письменно ответить на вопросы: 1) как получают аммиак в лаборатории?...
 D2a0h0a917.05.2021 19:44
D2a0h0a917.05.2021 19:44

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
