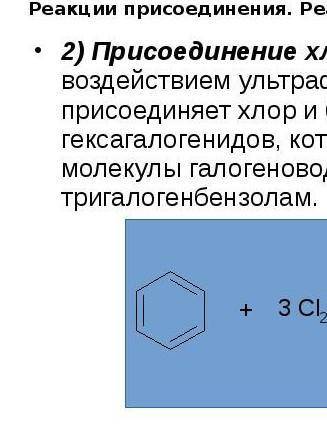
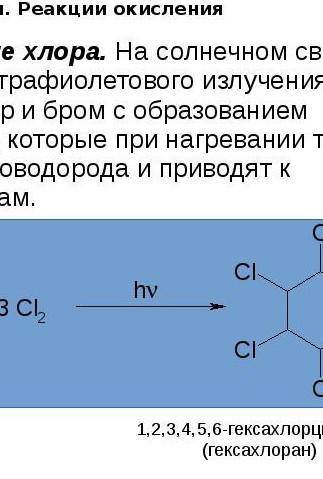
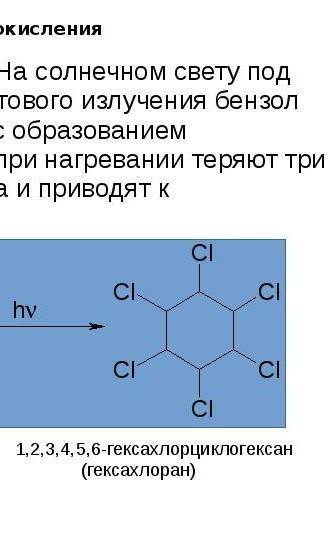
.РАСПИСАТЬ. ДАЮ 50 монет Складіть йонно-молекулярні рівняння реакцій, що відбуваються в розчині між такими електролітами:
а) ферум(ІІ) нітратом і барій гідроксидом;
б) натрій фторидом і хлоридною кислотою;
в) літій гідроксидом і сульфатною кислотою;
г) хром(ІІІ) сульфатом і калій ортофосфатом.
Ответы на вопрос:
Складіть йонно-молекулярні рівняння реакцій, що відповідають таким молекулярним рівнянням:
а) Mn(NO3)2 + Ba(OH)2 = Mn(OH)2↓ + Ba(NO3)2;
Спершу за таблицею розчинності визначаємо розчинні сполуки, а потім - які з них є сильними електролітами. Реагенти й один із продуктів реакції Ba(NO3)2— це сильні електроліти, які у водному розчині містяться виключно у вигляді йонів, а Mn(OH)2↓- нерозчинна основа. Зважаючи на це, замінюємо формули сильних електролітів формулами йонів:
Mn2+ + 2NO3- + Ba2+ + 2OH- = Mn(OH)2↓ + Ba2+ + 2NO3-
З обох частин отриманого рівняння вилучаємо (підкреслені) однакові йони в однакових кількостях Вa2+ і NO3–.
Mn2+ + 2OH- = Mn(OH)2↓
б) Na2S + H2SO4 = Na2SO4 + H2S↑;
Спершу за таблицею розчинності визначаємо розчинні сполуки, а потім - які з них є сильними електролітами. Реагенти й один із продуктів реакції Na2SO4— це сильні електроліти, які у водному розчині містяться виключно у вигляді йонів, а cульфідна кислота H2S↑ - летка сполука і слабкий електроліт на йони майже не дисоціює. Зважаючи на це, замінюємо формули сильних електролітів формулами йонів:
2Na+ + S2- + 2H+ + SO42- = 2Na+ + SO42- + H2S↑;
З обох частин отриманого рівняння вилучаємо (підкреслені) однакові йони в однакових кількостях Na+ і SO42-.
2H+ + S2- = H2S↑;
Хоча в повному йонному рівнянні спочатку записано сульфід-аніон S2-, а після нього катіон Гідрогену Н+, загальноприйнято розпочинати запис скорочених йонних рівнянь з катіонів.
в) 2KOH + CO2↑= K2CO3 + H2O;
Спершу за таблицею розчинності визначаємо розчинні сполуки, а потім - які з них є сильними електролітами. Реагент KOH й один із продуктів реакції K2CO3— це сильні електроліти, які у водному розчині містяться виключно у вигляді йонів, а кислотний оксид СО2 - неелектроліт та вода - слабкий електроліт на йони майже не дисоціює. Зважаючи на це, замінюємо формули сильних електролітів формулами йонів:
2K+ + 2OH- + CO2↑= 2K+ + CO32- + H2O;
З обох частин отриманого рівняння вилучаємо (підкреслені) однакові йони в однакових кількостях К+.
2OH- + CO2 = CO32- + H2O;
г) Ni(OH)2↓ + 2HCl = NiCl2 + 2H2O.
Спершу за таблицею розчинності визначаємо розчинні сполуки, а потім - які з них є сильними електролітами. Реагент HCl й один із продуктів реакції NaCl2 — це сильні електроліти, які у водному розчині містяться виключно у вигляді йонів, а Ni(OH)2↓ - нерозчинна основа та вода - слабкий електроліт на йони майже не дисоціює. Зважаючи на це, замінюємо формули сильних електролітів формулами йонів:
Ni(OH)2↓ + 2H+ + 2Cl- = Ni2+ + 2Cl- + 2H2O
З обох частин отриманого рівняння вилучаємо (підкреслені) однакові йони в однакових кількостях Cl-.
Ni(OH)2↓ + 2H+ = Ni2+ + 2H2O
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Какое массовое соотношение долей углерода и кислорода в молекулу глюкозы?...
 zelim712.05.2023 05:37
zelim712.05.2023 05:37 -
Вдвух пробирках даны: а) оксид кальция; б) оксид магния. определите,...
 Знаток22811118.11.2021 02:21
Знаток22811118.11.2021 02:21 -
Написати рівняння реакцій за схемами: 1)сн2=сн-сн3+нbr-ch2=ch-ch=ch2+h2...
 alia123456789116.05.2022 05:30
alia123456789116.05.2022 05:30 -
Чему равна сумма коэффицентов в сокращенном ионном уравнении взаимодействия...
 Qweyudbdbf02.02.2022 16:03
Qweyudbdbf02.02.2022 16:03 -
Составить все возможные изомеры c5h11no2...
 сим66620.09.2021 15:24
сим66620.09.2021 15:24 -
Вадном из пробирок находится вода, а в другой-хлорид калия. определите,...
 666662816.04.2021 09:11
666662816.04.2021 09:11 -
Доброго времени суток, , . заранее . щелочной метал массой 5,75 грамм...
 kami17929.07.2022 03:41
kami17929.07.2022 03:41 -
C5h11nh2 составить все возможные изомеры...
 MiSTiKA2304.03.2021 01:16
MiSTiKA2304.03.2021 01:16 -
Взаимодействуют ли амфотерные гидроксиды с водой? ?...
 193934506.05.2022 20:09
193934506.05.2022 20:09 -
1) вычислите массу 30% раствора фосфорной кислоты массой 200г 2) рассчитайте...
 dimaschastny27.09.2021 01:01
dimaschastny27.09.2021 01:01

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.