KI + KIO3 + H2SO4= K2SO4 + I2 + H2O Решить именно методом электронно-ионных полуреакций:
(1) Записать уравнение полуреакции окисления восстановителя;
(2) Записать уравнение полуреакции восстановления окислителя;
(3) Записать уравнение реакции в ионно-молекулярной форме;
(4) Записать суммарное уравнение реакции в молекулярной форме.
Ответы на вопрос:
KI + KIO₃ + H₂SO₄ → K₂SO₄ + I₂ + H₂O - молекулярное уравнение
K⁺ + I⁻ + K⁺ + IO₃⁻ + 2H⁺ + SO₄²⁻ → 2K⁺ + SO₄²⁻ + I₂⁰ + H₂O - Полное ионное уравнение
IO₃⁻ + 12H⁺ + 10e⁻ → I₂ + H₂O | 10 | | 1 | - Окислитель - Восстановление
| | 10 | |
2I⁻ - 2e⁻ → I₂⁰ | 2 | | 5 | - Восстановитель - Окисление
Получим:
10I⁻ + 2IO₃⁻ + 12H⁺ → 6I₂ + 6H₂O
В результате получаем вот такое уравнение:
10KI + 2KIO₃ + 6H₂SO₄ → 6K₂SO₄ + 6I₂ + 6H₂O | : 2
5KI + KIO₃ + 3H₂SO₄ → 3K₂SO₄ + 3I₂ + 3H₂O
Теперь напишем его молекулярную и ионной форме:
5KI + KIO₃ + 3H₂SO₄ → 3K₂SO₄ + 3I₂ + 3H₂O - Молекулярное уравнение
5K⁺ + 5I⁻ + K⁺ + IO₃⁻ + 6H⁺ + 3SO₄²⁻ → 6K⁺ + 3SO₄²⁻ + 3I₂ + 3H₂O - Полное ионное уравнение
5I⁻ + IO₃⁻ + 6H⁺ → 3I₂ + 3H₂O - Сокращенное ионное уравнение
Решено от : 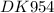
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
20. Установите соответствие. Вещество Соотношение m(N):m(O) 1....
 Volchara009.02.2022 04:40
Volchara009.02.2022 04:40 -
Какие смеси разделяют методом дистиляцци? 1.этиловый спирт +вода;2.растительное...
 ПотнаяБабка200019.05.2021 01:59
ПотнаяБабка200019.05.2021 01:59 -
9. В каком случае в составе веществ имеется одинаковое число атомов?...
 Карина220904.02.2022 10:56
Карина220904.02.2022 10:56 -
Смешивают попарно растворы: а) KOH и Mg (NO3)2; б) Li2СO3 и HCI;...
 Kirillf200628.02.2023 00:11
Kirillf200628.02.2023 00:11 -
Укажіть речовини, з якими може регулювати хлоридна кислота...
 LAKI228004130.10.2020 04:07
LAKI228004130.10.2020 04:07 -
Укажіть речовини х у схемі реакції х+КОН-К2SO3+H2O...
 korolovk16.06.2022 21:56
korolovk16.06.2022 21:56 -
Укажіть групу речовини,з якими взаємодіють кислотні оксиди...
 ttania444413.04.2021 14:29
ttania444413.04.2021 14:29 -
ААААА ДО ТЬ ДУЖЕ ПОТРІБНООООО! Помістивши у воду 7,8 г лужного...
 LikkaSchool20527.08.2020 20:51
LikkaSchool20527.08.2020 20:51 -
В яких одиницях вимірюється масова частка речовини?...
 Помогите2344104.02.2020 08:04
Помогите2344104.02.2020 08:04 -
У результаті взаємодії міді масою 64 г з розчином аргентум 1 нітрату...
 69Unicorn6919.06.2020 07:36
69Unicorn6919.06.2020 07:36

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
