Ответы на вопрос:
1) Для начала мы запишем схему гальванического элемента:
Pt | Fe⁺³(0,1 моль/л) , Fe⁺²(10⁻² моль/л) || Au⁺(10⁻² моль/л), Au⁺³(0,1 моль/л) | Pt
2) Далее мы определяем какой из них катод и анод, значит из этого гальванического элемента:
Fe - Анод Au - Катод
A⁻ : Pt | Fe⁺³(0,1 моль/л) , Fe⁺²(10⁻² моль/л) || Au⁺(10⁻² моль/л), Au⁺³(0,1 моль/л) | Pt : K⁺
3) Теперь записываем гальванические процессы у катода и анода и потом получим уравнение токообразующей реакции :
K⁺ : Fe⁺² - 1e⁻ → Fe⁺³ | 1 | | 2 | - восстановитель E₁° = -0,77 В
| | 2 | |
A⁻ : Au⁺³ + 2e⁻ → Au⁺ | 2 | | 1 | - окислитель E₂° = 1,40 В
2Fe⁺² - 2e⁻ + Au³⁺ + 2e⁻ → 2Fe⁺³ + Au⁺
2Fe⁺² + Au³⁺ → 2Fe⁺³ + Au⁺ - токообразующая реакция
4) Теперь находим ЭДС у катода и анода по такой формуле:
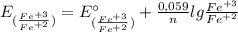
E(Fe⁺³/Fe⁺²) = -0,77 В + 0,059/1 × lg (0,1 моль/л / 10⁻² моль/л) = -0,77 В + 0,059 × lg (0,1 / 0,01) = -0,77 В + 0,059 × lg 10 = -0,77 В + 0,059 × 1 = -0,77 В + 0,059 = -0,711 В
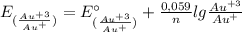
E(Au⁺³/Au⁺) = 1,40 В + 0,059/2 × lg (0,1 моль/л / 10⁻² моль/л) = 1,40 В + 0,0295 × lg (0,1 / 0,01) = 1,40 В + 0,0295 × lg 10 = 1,40 В + 0,0295 × 1 = 1,40 В + 0,0295 = 1,4295 В ≈ 1,43 В
5) Теперь находим ЭДС по полученным значениях :
ε = E(катод) - E(анод) = E(Au⁺³/Au⁺) - E(Fe⁺³/Fe⁺²) = 1,43 В - (-0,711 В) = 1,43 В + 0,711 В = 2,141 В
ответ: ε = 2,141 В
Решено от : 
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Fe-fe2o3-fecl3-fe2(so4)3-fe(oh)3-fe2o3-fe-fecl3-agcl не пойму...
 nightmarelucy23.11.2022 17:41
nightmarelucy23.11.2022 17:41 -
Вычислить массовую долю растворенного вещества , если в 68 г...
 boha309.02.2021 09:48
boha309.02.2021 09:48 -
Расставьте коэффиценты в окислительно - восстановительной реакции...
 мака200727.06.2020 10:46
мака200727.06.2020 10:46 -
Решить дано: v(h2s)=12л найти: n-? m-? p( do2-? n-?...
 НектоПожизни30.05.2023 22:47
НектоПожизни30.05.2023 22:47 -
Каково строение соединения состава с8н18, если известно, что...
 veselova99916.06.2020 22:52
veselova99916.06.2020 22:52 -
При сжигании 15 л смеси ch4 и c2h6 образовалось 27 л углекислого...
 DAMALOVE08.01.2022 23:31
DAMALOVE08.01.2022 23:31 -
Відносна атомна маса Флуору: а) 18 б) 19 в) 9...
 saitovdamir20Damit22.11.2020 19:18
saitovdamir20Damit22.11.2020 19:18 -
Написать уравнения реакций в молекулярном и ионом виде: 1.mgcl2...
 Skapisheva1515151519.02.2020 08:53
Skapisheva1515151519.02.2020 08:53 -
Петя ,работая в школьной лаборатории под присмотром учителя...
 Kto6to14.03.2020 05:21
Kto6to14.03.2020 05:21 -
Выражение константы равновесия обратимой реакции: n2+o2 -- no...
 lyababaranik07.09.2021 10:23
lyababaranik07.09.2021 10:23

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
