Какой объём 10%-ного раствора Na2CO3 с плотностью ( p=1,10 г/мл) потребуется для приготовления 500 мл его раствора с молярной концентрацией эквивалента 1 моль-экв/л решить задачу подробно ( с объяснением
Ответы на вопрос:
Дано:
CdCl₂ (раствор)
t = 20 мин. = 1200 сек
I = 2 А
η = 100%
Найти:
m(Cd) - ? V(Cl₂) - ?
1) Для начала мы запишем электролиз раствора хлорида кадмия (II):
CdCl₂(раствор) → Cd²⁺ + 2Cl⁻
Катод Анод
K⁻ : Cd²⁺ + 2e⁻ → Cd⁰ | 2 | | 1 | - окислитель - восстановитель
| | 2 | |
A⁺ : 2Cl⁻ - 2e⁻ → Cl₂⁰↑ | 2 | | 1 | - восстановитель - окисление
Cd²⁺ + 2e⁻ + 2Cl⁻ - 2e⁻ → Cd⁰ + Cl₂⁰
Cd²⁺ + 2Cl⁻ → Cd⁰ + Cl₂⁰
CdCl₂(раствор) (эл. ток.) → Cd + Cl₂↑
2) Далее находим массу вещества полученного на катоде при 2-го закона Фарадея:
m(Cd) = (M(Cd) × I × t)/(n × F) × η = (112 гр/моль × 2 А × 1200 сек) / (2 × 96500 Кл/моль) × 100% = (56 гр/моль × 2 Кл/сек × 1200 сек) / (96500 Кл/моль) × 1 = (56 гр/моль × 2400 Кл) / (96500 Кл/моль) × 1 ≈ 56 гр/моль × 0,025 моль × 1 ≈ 1,4 гр
3) Теперь находим объем газа выделившегося на аноде:
V(Cl₂) = (Vm(Cl₂) × I × t) / (n × F) × η = (22,4 л/моль × 2 А × 1200 сек) / (2 × 96500 Кл/моль) × 100% = (11,2 л/моль × 2 Кл/сек × 1200 сек) / (96500 Кл/моль) × 1 = (11,2 л/моль × 2400 Кл) / (96500 Кл/моль) × 1 ≈ 11,2 л/моль × 0,025 моль × 1 ≈ 0,28 л
4) Вещество будет выделяться на электродах при замене инертного анода на металлический - это кадмий, так как на катоде будет восстанавливаться кадмием, анод будет растворяться:
A⁺ : Cd⁰ - 2e⁻ → Cd²⁺
ответ: m(Cd) = 1,4 гр ; V(Cl₂) = 0,28 л
Решено от : 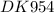
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Вам предложен перечень взаимосвязанных понятий: а. медь б. металл b. вещество...
 tyyyyyj08.05.2021 16:42
tyyyyyj08.05.2021 16:42 -
Масова частка ca у сполуці з h становить 0.952 яка маса h міститься у 10 грамах...
 masaa842715.01.2021 13:08
masaa842715.01.2021 13:08 -
Напишите уравнения реакций железа с бором,хлором,разбавленной серной кислотой,раствором...
 Julianne1116.07.2020 04:37
Julianne1116.07.2020 04:37 -
Составить уравнения реакций по схеме: c-co2-caco3-co2-na2co3 указать типы реакций,...
 cosmoniksplay916.05.2020 22:21
cosmoniksplay916.05.2020 22:21 -
1) изменяя площадь соприкосновения реагирующих веществ, можно влиять на скорость...
 PavelTop10016.09.2021 16:53
PavelTop10016.09.2021 16:53 -
При взаимодействие магния с избытком раствора серной кислоты выделился водород...
 Karumi102.04.2020 04:46
Karumi102.04.2020 04:46 -
Обнаружение ионов в растворе при качественных реакций...
 аоаоаоаоатте19.05.2023 10:19
аоаоаоаоатте19.05.2023 10:19 -
Визначте масу натрій сульфату декагідрату й води в розчині масою 300 г - з масовою...
 камила201015.03.2023 03:12
камила201015.03.2023 03:12 -
Значения побочного (орбитального) квантового числа для второго энергетического...
 VanoK4804.01.2020 12:38
VanoK4804.01.2020 12:38 -
Укажите вещества гомологи. 1)этан и пропен 2)бутан и гексен 3)этанол и пропанол...
 luzgina1127.08.2022 03:40
luzgina1127.08.2022 03:40

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
