решить задачу:
Какой объеv CO2 выделится при горении 80-ти литров метана?
182
244
Ответы на вопрос:
Дано:
V(CH₄) = 80 л
Найти:
V(CO₂) - ?
1) Для начала мы запишем уравнение реакций для горения метана, именно по такой уравнений реакций мы найдем объем углекислого газа:
CH₄ + 2O₂ → CO₂ + 2H₂O
2) Для начала мы найдем количества вещества у метана, а потом у углекислого газа по уравнению реакций:
Vm = 22,4 л/моль
n(CH₄) = V(CH₄)/Vm = 80 л / 22,4 л/моль ≈ 3,57 моль ⇒ n(CO₂) = n(CH₄) = 3,57 моль - по уравнению реакций
3) Теперь находим объем углекислого газа:
V(CO₂) = n(CO₂)×Vm = 3,57 моль × 22,4 л/моль = 79,968 л ≈ 79,97 л
ответ: V(CO₂) = 79,97 л
Решено от : 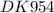
4p + 5o₂ = 2p₂o₅ n(p)/4 = n(p₂o₅)/2 или n(p)/2 = n(p₂o₅) p₂o₅ + 6koh = 2k₃po₄ + 3h₂o n(p₂o₅) =n(koh)/6 = n(k₃po₄)/2 n(p) = m/m = 6,2 г/31 г/моль = 0,2 моль n(p₂o₅) = n(p)/2 = 0,2 моль : 2 = 0,1 моль m(р.koh) = v(р.koh) * ρ = 140 мл * 1,14 г/мл = 159,6 г. m(koh) = ω*m(р.koh) = 0,14* 159,6 г. = 22,34 г n(koh) = m/m = 22,34/56 г/моль = 0,4 моль -- гидроксид калия взят в недостатке, так как на один моль оксида фосфора(v) расходуется 6 молей гидроксида калия , то есть на 0,1 моль p₂o₅ должно израсходоваться 0,6 моль koh. cчитаем по недостатку. n(k₃po₄)/2 = n(koh)/6 или n(k₃po₄)= n(koh)/3 = 0,4 моль: 3 = 0,13 моль m(k₃po₄) = n*m = 0,13 моль * 212 г/моль = 27,56 г. ω(k₃po₄) = m(k₃po₄)/m(р-ра) * 100% = 27, 56 г./(159,6 г + 6,2 г) * 100 % = 16,6%
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Ca(hco3)2 struktura formula...
 09Катя9910.08.2020 16:10
09Катя9910.08.2020 16:10 -
Напишите молекулярные и ионные уравнения реакций, с которых можно осуществить...
 Папарапдрд19.04.2020 15:45
Папарапдрд19.04.2020 15:45 -
Заполнить таблицу по химии! (скриншот ниже писать, что качество скришота...
 dauren13002.11.2020 13:59
dauren13002.11.2020 13:59 -
В молекуле Sx содержится 64 электрона. Укажите значение х...
 леон1530.04.2022 00:39
леон1530.04.2022 00:39 -
Під час нагрівання кристалічної соди Na2C03 * nH2O масою 2,86 г маса...
 maximbelov0024.02.2021 10:03
maximbelov0024.02.2021 10:03 -
те кто хорошо знает химию ♥️...
 kaitva1509.07.2022 07:16
kaitva1509.07.2022 07:16 -
Очень у розчині масою 200г містився барій нітрат. для його повного...
 Центравой30.11.2022 01:41
Центравой30.11.2022 01:41 -
Разработайте план действий после смеси поваренной соли и песка...
 svetokot200519.02.2023 03:52
svetokot200519.02.2023 03:52 -
Возможно ли существование в природных условиях Земли свободного металлического...
 мико14131.10.2020 21:27
мико14131.10.2020 21:27 -
Какой объект находится между озерами Эри и Онторие...
 Xro812.09.2020 02:52
Xro812.09.2020 02:52

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
