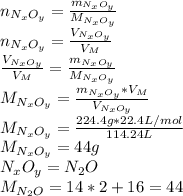Вариант-1 1.Какая масса калия вступит в реакцию с 17,75г хлора?
2.Найти массу образовавшейся соли при взаимодействии соляной кислоты и
алюминия массой 81 г.
3.Какая масса брома выделится при разложении бромида натрия массой 51,5 г?
Вариант-2
1.Какая масса магния вступит в реакцию с 142 г хлора?
2.Найти массу образовавшейся соли при взаимодействии соляной кислоты и
железа массой 224 г.
3.Какая масса йода выделится при разложении иодида натрия массой 300 г?
298
365
Ответы на вопрос:
только первый вариант, дальше не знаю
Объяснение:
1.m(CL2) = 17.75 g
m(FeCL2)-?
17.75 X
2Fe+3CL2-->2FeCL3 M(CL2) = 71 g/mol , M(FeCL3) = 162.5 g/mol
3*71 2*162.5
X = 17.75 * 325 / 213 = 27.08 g
ответ 27.08 г
2.m(AlCl3) = 81 * 267 / 54 =400,5 г.
3.2Na + Br₂ → 2NaBr
νNaBr = mNaBr/μNaBr = 5,15 г / 103 г/моль = 0,05 моль
νNa = νNaBr = 0,05 моль
νBr₂ = νNaBr/2 = 0,025 моль
mNa = 0,05 * 23 = 1.15 г
mBr₂ = 0,025 * 160 = 4 г
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
При разложении какого соединения образуется два простых вещества...
 mariialebedeva28.01.2021 07:43
mariialebedeva28.01.2021 07:43 -
Объясните, как можно более подробно❤️❤️❤️...
 rodnevadaria17.03.2020 05:33
rodnevadaria17.03.2020 05:33 -
Напишите формулы линейных трипептидов, состав которых входят по...
 Лоликус18.07.2022 00:34
Лоликус18.07.2022 00:34 -
Вещество,полученное из одного вида атомов: а)кислород б)озон в)вода...
 бэлла3125.01.2020 13:31
бэлла3125.01.2020 13:31 -
2. заполните таблицу « свойства кислот»: поставьте знаки «+» , где...
 nikitaursu1131.08.2022 12:28
nikitaursu1131.08.2022 12:28 -
Напишите уравнения свойств: naclcuso4fe(no3)2k2co2...
 chapllinshow12.07.2022 18:38
chapllinshow12.07.2022 18:38 -
Определите степень окисления элементов в соединениях 35 БАЛЛОВ BF3...
 bon110101.02.2022 12:33
bon110101.02.2022 12:33 -
Гексан → бензол → фенол → фенолят калия → 2,4,6 трибромфенол Составить...
 KeberMax23.01.2022 00:07
KeberMax23.01.2022 00:07 -
Решить тест (уметь объяснить выбранный ответ) №1. Усиление металлических...
 Viper39721.08.2022 13:42
Viper39721.08.2022 13:42 -
Все бали до 12 утра ...
 annsamoilenko1607.05.2021 18:02
annsamoilenko1607.05.2021 18:02

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.