8класс составьте уравнения реакций,схемы которых даны ниже: а)ca-> cao-> ca(oh)2-> ca(no3)2-> caso4 б)fe2(so4)3-> fe(oh)3-> fe2o3-> fe2(so4)3
Ответы на вопрос:
7994 грамма
Объяснение:
Известен тип реакции(обмена) основания и ангидрида:
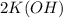 +
+ 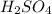 =
= 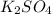 +
+ 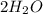
Если раствор сульфата калия и воды это 100% то вычитая из массы раствора массу серной кислоты можно получить процент содержания основания в реагентах.
Вычислить процент серной кислоты в составе реагентов так как по закону сохранения масс веществ реакция не меняет числовые значения содержания атомов элементов в растворе.
Процент вещества в составе смеси реагентов вычисляется сравнения относительной молекулярной массы нужного соединения с суммой масс веществ всего раствора:
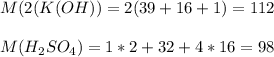
112+98 = 210 дальтон => 98:210*100 = 46,(6) % - процент массы кислоты
значит процент основания от общей массы 53.4%
Процент воды в растворе продуктов 21%
21/79 = 0.26 => 0.26* 13552 = 3602.4 г -масса воды в растворе
13552 + 3602.4 = 17154,4г масса всего раствора продуктов
53.4 / 100 * 17154.4г = 9160,4 г - масса серной кислоты в реагентах
Следовательно:
17154.4г - 9160,4 = 7994 грамма гидроксида калия было израсходовано
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Как изменится скорость реакции: а) при изменении объема газовой смеси; б) при...
 gyulmalievasab17.11.2022 14:34
gyulmalievasab17.11.2022 14:34 -
Химия решить задачи) 65 баллов...
 taysonrelect11.04.2023 06:49
taysonrelect11.04.2023 06:49 -
До розчину глюкози масою 200 г з масовою часткою речовини 10% долили води об...
 Sofiaminkina0621.10.2020 09:11
Sofiaminkina0621.10.2020 09:11 -
Розчин цукру масою 400 г з масовою часткою 20% влили в розчин маосю 600г. з...
 Олег431130.01.2023 15:30
Олег431130.01.2023 15:30 -
. Розрахувати об’єм водню, що утворився при дегідруванні 20 л етану...
 vamagic200127.03.2021 14:02
vamagic200127.03.2021 14:02 -
Розчин кислоти змінює колір індикатора метилового оранжевого на: а) синій;...
 vikakivi120623.08.2020 02:19
vikakivi120623.08.2020 02:19 -
Решить ! определите массу алюминия если число атомов его составляет 12*10(в...
 SUPERMOZGgg29.10.2020 10:51
SUPERMOZGgg29.10.2020 10:51 -
Каковы различия и что общего в составе ядер изотопа...
 Roman78978914.06.2021 11:51
Roman78978914.06.2021 11:51 -
дайте. хоть что нибудь побыстрее , у меня есть 10 мин ...
 kr2804ilyagmailcom18.10.2020 06:53
kr2804ilyagmailcom18.10.2020 06:53 -
Соотнесите значение рН и вещества имеющие эти значения ...
 NoNameKek1Himka07.01.2023 05:07
NoNameKek1Himka07.01.2023 05:07

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
