К60 г 60%-ного раствора нитрита серебра добавили 40 мл воды. массовая доля нитрата серебра в полученном растворе равна % минимальное количество вещества серной кислоты, необходимое для получения 11,2 л водорода .
Ответы на вопрос:
1. а) сначала необходимо найти массу нитрата в первом растворе:
m(agno3)=m1(раствора)*w1(agno3)=60*0,6=36 г
б) теперь определим массу нового раствора,после добавления воды:
m2(раствора)=m1(растворара)+m(h2o)=60+40=100 г(г с мл смешивать нельзя,но учитывая,что плотность воды равна 1 г/мл,поэтому 40 мл численно равно 40 г воды)
в)теперь,отнеся массу соли(так как она не изменилась) к массе нового раствора и получим вторую массовую долю:
w2(agno3)=m(agno3)/m2(раствора)=36/100=0,36 или 36%
х моль 11,2 л
2. →
1 моль 22,4 л
при взаимодействии 1 моль кислоты выделяется 22,4 л водорода, а
при -- // -- х ,2 л, откуда
х=1*11,2/22,4=0,5 моль
1) Реакция:
2Mg + O2 > MgO
2) Дано и найти:
m (Mg) = 12 гр.
Mr (Mg) = 24.
V (O2) = 1,12 гр.
Vm (O2) = 22,4 л.
M (MgO) = 40.
m (MgO) = ?
3) Решение:
12 1,12 x
2Mg + O2 > MgO
2 × 24 22,4 2 × 40
4) Составляем пропорцию:
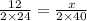
5) Сокращаем и решаем:
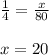
или
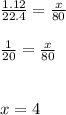
ответ: Если найти по магнию - 20 гр., а если найти по кислороду - 4 гр..
a = 20.
b = 4.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
К87 г раствора с массовой долей сульфата калий 8% добавили избыток...
 Aлинa1114.07.2021 10:30
Aлинa1114.07.2021 10:30 -
Контрольная работа №2 1. а) общая характеристика металлов по...
 bugemila36id30.04.2021 09:21
bugemila36id30.04.2021 09:21 -
Сколько тепла выделится при сгорании 70 г лития...
 055637211315.02.2022 07:23
055637211315.02.2022 07:23 -
Придумайте условие , в которой нужно найти число молекул n,...
 muharadjab14.05.2020 10:36
muharadjab14.05.2020 10:36 -
Які власності (окисні чи відновні виявляє гідрогенсульфур та...
 maria2701200705.04.2020 01:49
maria2701200705.04.2020 01:49 -
Назвать вещества посередине...
 Sashaklapp07.01.2022 22:41
Sashaklapp07.01.2022 22:41 -
осуществите синтез соединения б, используя в качестве исходного...
 mrzus02.07.2022 00:22
mrzus02.07.2022 00:22 -
Рассчитайте плотность следующих газов (н. у.): аммиака nh3,...
 SpaniGar05.09.2020 18:48
SpaniGar05.09.2020 18:48 -
Структурная формула 2-амино-3-меркапто-3-метил-бутанолу....
 Aldatik17.12.2020 14:24
Aldatik17.12.2020 14:24 -
Zn - zncl2 - zn(oh)2 - zn(oh)cl осуществить схему превращений,...
 Dasha230230.12.2022 07:03
Dasha230230.12.2022 07:03

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
