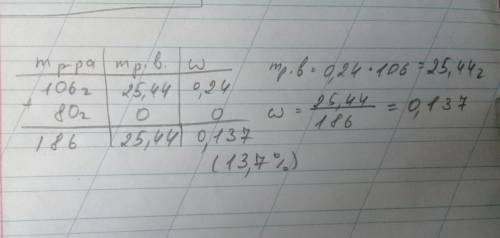К 106 г раствора серной кислоты с массовой долей 24 % добавили 80 г воды. Вычисли массовую долю (%) серной кислоты в образовавшемся растворе. Точность промежуточных вычислений — до тысячных. ответ округли до десятых. Например: 24,1.
ответ: массовая доля серной кислоты равна( ) %.
Ответы на вопрос:
ответ: 13.7 %
Объяснение:
Дано:
m(раствора H2SO4) = 106 г
w1(H2SO4) = 24% = 0.24
m(H2O доб.) = 80 г
Найти: w2(H2SO4) - ?
m(H2SO4) = m(раствора H2SO4) * w1(H2SO4) = 106 г * 0.24 = 25.440 г
m(нового раствора) = m(раствора H2SO4) + m(H2O доб.) = 106 г + 80 г = 186 г
w2(H2SO4) = m(H2SO4) / m(нового раствора) * 100% = 25.440 г / 186г * 100% ≈ 13.677 % ≈ 13.7 %
ответ: массовая доля серной кислоты равна 13.7 %
v(vozduha)=v(o2) / w(vozduha) = 50 / 0,21 = 238 dm3
v(co2) = v(vozduha) * w(co2) = 238 * 0,0314 = 7,4732 dm3
v(he) = v(vozduha) * w(he) = 238 * 0,000524 = 0,124712 dm3
v(ne) = v(vozduha) * w(ne) = 238 * 0,001818 = 0,432684 dm3
v(ar) = v(vozduha) * w(ar) = 238 * 0,934 = 222,292 dm3
v(kr) = v(vozduha) * w(kr) = 238 * 0,000114 = 0,027132 dm3
v(xe) = v(vozduha) * w(xe) = 238 * 0,0000087 = 0,0020706 dm3
все
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
всего 5 ва В ряду элементов N - P - As уменьшается радиус атома; Выберите...
 CassyBelka21.01.2021 22:11
CassyBelka21.01.2021 22:11 -
Верны ли следующие утверждения об озоне? а. озон в стратосфере поглощает часть...
 Matveu33123.08.2020 21:07
Matveu33123.08.2020 21:07 -
Сцепочкой ch3-ch2-ch2-oh + ch3-c=o-oh...
 dhkbzdyjnxx11.01.2023 21:57
dhkbzdyjnxx11.01.2023 21:57 -
Визбытке воды растворили оксид серы(6) массой 40г. какое вещество образуется...
 Пеперони22826.07.2020 20:06
Пеперони22826.07.2020 20:06 -
Как правильно работать с индекаторами?...
 20лиза0712.04.2022 20:56
20лиза0712.04.2022 20:56 -
Іть будь ласка закінчити реакцію hcooh+ch3oh=...
 MaxXXL200317.11.2021 13:48
MaxXXL200317.11.2021 13:48 -
После пропускания через раствор гидроксида калия 4,48 л сернистого газа получили...
 torra1120.08.2022 23:42
torra1120.08.2022 23:42 -
Дописать уравнение реакций zncl2+cu=? , na+h2o=? , al+s=? , fe+mg(no3)2=?...
 askerovaa109.08.2022 22:20
askerovaa109.08.2022 22:20 -
Какое количество вещества углекислого газа образуется при разложении 200 г....
 Кирилл4235225.04.2023 08:49
Кирилл4235225.04.2023 08:49 -
Обчисліть масові частки елементів у глюкозі,формула якої c6h12o6...
 masadropd119.09.2021 21:54
masadropd119.09.2021 21:54

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.