Ответы на вопрос:
CuO + 2HCl = CuCl₂ + H₂O
Cucl2+ H2SO4= CUSO4+ 2HCl
CuSO₄ + 2NaOH = Cu(OH)₂ + Na₂SO₄
1) Для начала мы запишем схему гальванического элемента:
Pt | Fe⁺³(0,1 моль/л) , Fe⁺²(10⁻² моль/л) || Au⁺(10⁻² моль/л), Au⁺³(0,1 моль/л) | Pt
2) Далее мы определяем какой из них катод и анод, значит из этого гальванического элемента:
Fe - Анод Au - Катод
A⁻ : Pt | Fe⁺³(0,1 моль/л) , Fe⁺²(10⁻² моль/л) || Au⁺(10⁻² моль/л), Au⁺³(0,1 моль/л) | Pt : K⁺
3) Теперь записываем гальванические процессы у катода и анода и потом получим уравнение токообразующей реакции :
K⁺ : Fe⁺² - 1e⁻ → Fe⁺³ | 1 | | 2 | - восстановитель E₁° = -0,77 В
| | 2 | |
A⁻ : Au⁺³ + 2e⁻ → Au⁺ | 2 | | 1 | - окислитель E₂° = 1,40 В
2Fe⁺² - 2e⁻ + Au³⁺ + 2e⁻ → 2Fe⁺³ + Au⁺
2Fe⁺² + Au³⁺ → 2Fe⁺³ + Au⁺ - токообразующая реакция
4) Теперь находим ЭДС у катода и анода по такой формуле:
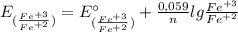
E(Fe⁺³/Fe⁺²) = -0,77 В + 0,059/1 × lg (0,1 моль/л / 10⁻² моль/л) = -0,77 В + 0,059 × lg (0,1 / 0,01) = -0,77 В + 0,059 × lg 10 = -0,77 В + 0,059 × 1 = -0,77 В + 0,059 = -0,711 В
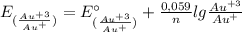
E(Au⁺³/Au⁺) = 1,40 В + 0,059/2 × lg (0,1 моль/л / 10⁻² моль/л) = 1,40 В + 0,0295 × lg (0,1 / 0,01) = 1,40 В + 0,0295 × lg 10 = 1,40 В + 0,0295 × 1 = 1,40 В + 0,0295 = 1,4295 В ≈ 1,43 В
5) Теперь находим ЭДС по полученным значениях :
ε = E(катод) - E(анод) = E(Au⁺³/Au⁺) - E(Fe⁺³/Fe⁺²) = 1,43 В - (-0,711 В) = 1,43 В + 0,711 В = 2,141 В
ответ: ε = 2,141 В
Решено от : 
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Сколько г этанола получится при брожении 450 г фруктозы, если выход...
 vika2356207.07.2021 11:48
vika2356207.07.2021 11:48 -
Запишите формулы соединений этих элементов: оксид, гидроксид,л.в.с,укажите...
 loon148824.07.2020 19:17
loon148824.07.2020 19:17 -
Скакими из перечисленных веществ взаимодействует соляная кислота:...
 kirillnesterov0605.05.2020 05:19
kirillnesterov0605.05.2020 05:19 -
Расчитайте массу соли, которая образовалась при взаимодействии...
 Машка415514.04.2022 03:33
Машка415514.04.2022 03:33 -
Изобразить электронные конфигурации атомов,укажите тип(s-,р-,d-)...
 radmirhik270610.06.2023 18:40
radmirhik270610.06.2023 18:40 -
1. определите тип связи фторида кальция: а)ковал.неполярная; б)...
 lololololo731.01.2022 09:43
lololololo731.01.2022 09:43 -
Ккарбонату кальция, массой 50 г добавили раствор содержащий азотную...
 kaanekiken13.04.2022 05:09
kaanekiken13.04.2022 05:09 -
Найдите массу кремниевой кислоты, полученной при взаимодействии...
 снежок34511.10.2020 00:38
снежок34511.10.2020 00:38 -
Найти объём газа выход которого составил 97 %,который образуется...
 protasovarsenip0a3kn31.07.2022 14:06
protasovarsenip0a3kn31.07.2022 14:06 -
Реакции ионного обмена : nh4cl+koh na2so3+h2so4 alcl3+agno3 mgcl2+koh...
 kidsers2017Milllooo25.04.2023 15:55
kidsers2017Milllooo25.04.2023 15:55

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
