Расчитайте сколько грамм щёлочи выделиться при действии 23 грамм натрия на воду
294
479
Ответы на вопрос:
Вычислить массу щелочи, что образуется при взаимодействии 2.3 г натрия с достаточным количеством воды. 1. Смотреть ответ. helenaal helenaal. 2Na +H₂O = 2NaOH +H₂ По реакции из 2-х молей натрия образуется 2 моля едкого натра Mr(Na)=23(г/моль), Vr(NaOH)= 23+16+1=40(г/моль) 2,4 г натрия - это 2,3г : 23г/моль = 0,1 моля. Значит и щелочи получится тоже 0,1 моля. 0,1моля · 40г/моль= 4 г NaОН.
Объяснение:
Надеюсь что
40 грам
Объяснение:
2Na + 2H₂O → 2NaOH + H₂
Такие задания решаются благодаря равенству количества вещества, которое находится по формуле:
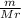 , где m - масса вещества, а Mr - молярная масса.
, где m - масса вещества, а Mr - молярная масса.
Запишем нашу пропорцию: 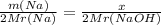
Mr(Na) = 23 грам/моль
Mr(NaOH) = 23 + 16 + 1 = 40 грам/моль
Таким образом:
x = 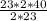 = 40 грам.
= 40 грам.
H2so4 - серная кислота n = m/m n(h2so4) = 49 г / (1*2 + 32 + 16*4 г/моль) = 0,5 моль
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Напишите уравнения реакций в полной и сокращённой ионных формах....
 Сергей190130.06.2022 18:55
Сергей190130.06.2022 18:55 -
Ответьте на вопросы а) что мы делаем воздуху, б)что является продуктом...
 azizplay0727.09.2021 09:21
azizplay0727.09.2021 09:21 -
Какая масса оксида углерода(2) должна вступить в реакцию для полного...
 FJFJKD9918.04.2023 02:08
FJFJKD9918.04.2023 02:08 -
С50 какой должна быть масса образца алюминия, чтобы в нём содержалось...
 ok68300020.12.2022 06:15
ok68300020.12.2022 06:15 -
34 ! решите масса раствора (h2so4)=60 массовая доля (h2so4)=10%...
 anastasiaselina18.12.2022 16:26
anastasiaselina18.12.2022 16:26 -
Добудьте із кристалогідрату mgso4∙7h2o розчин магній хлориду....
 12589426.06.2020 13:08
12589426.06.2020 13:08 -
Всем ! ! составьте молекулярные и ионные уравнения реакций протекающих...
 Dumbass100727.10.2022 20:01
Dumbass100727.10.2022 20:01 -
8класс. дайте определение ковалентной полярной связи. укажите и...
 madara01405.03.2022 07:40
madara01405.03.2022 07:40 -
Смесь фенола и стерола растворенные в уксусной кислоте реагирует...
 агамтасия05.10.2020 02:47
агамтасия05.10.2020 02:47 -
Расставьте коэффициенты в схемах реакций: а) al + s → al2s3 б)...
 dakar364231.05.2020 19:16
dakar364231.05.2020 19:16

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
