Для растворения 5,6г оксида двухвалентного металла потребовалось 25г 29,2% соляной кислоты. Оксид какого металла был взят? ответ :CaO
Ответы на вопрос:
Дано:
m (MeO) = 5,6 г;
m (HCl) = 25 г;
ω (HCl) = 29,2 %.
Найти:
Me (металл) — ?
1. Так как это оксид двухвалентного металла, мы можем записать реакцию в общем виде.
MeO + 2HCl → MeCl₂ + H₂O.
2. Найдём массу чистого HCl.
m (HCl) = (29,2 % · 25 г) ÷ 100 = 7,3 (г) - чистого HCl.
3. Теперь найдём количество вещества (моль) HCl. По формуле: n = m ÷ M; где: n - количество вещества (моль), m - масса (г), M - молярная масса (г/моль).
n (HCl) = 7,3 г ÷ 36,5 г/моль = 0,2 (моль).
4. Через соотношение количества вещества MeO и HCl найдём число моль MeO.
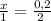 ; x = 0,1 (моль) - MeO.
; x = 0,1 (моль) - MeO.
5. Нам известна масса и количество вещества оксида металла. Теперь найдём молярную массу по формуле: M = m ÷ n; где: M - молярная масса (г/моль), m - масса (г), n - количество вещества (моль).
M (MeO) = 5,6 г ÷ 0,1 моль = 56 (г/моль).
6. Из найденной молярной массы вычтем кислород и узнаем молярную массу металла.
56 г/моль - 16 г/моль = 40 (г/моль).
Смотрим по таблице Менделеева... Это кальций (Ca).
ответ: CaO.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Рассчитайте, какой будет молярность 4 литров раствора, содержащего...
 dascha21schou01.04.2022 01:36
dascha21schou01.04.2022 01:36 -
Дайте названия углеводороду СН3 – СН – СН2 – СН3 | СН3 ...
 volter1626.08.2020 14:10
volter1626.08.2020 14:10 -
Предлагаю вашему вниманию одно из примерных сочинений. Как вы...
 aselkulmagambet18.04.2023 11:47
aselkulmagambet18.04.2023 11:47 -
Определите относительную плотность CO2 по кислороду (химия 8...
 ариша03730.03.2021 22:58
ариша03730.03.2021 22:58 -
1.Дайте характеристику гидроксиду по количеству групп OH 1)...
 pashalol303.03.2023 00:53
pashalol303.03.2023 00:53 -
. Во сколько раз различаются растворимости (моль/л) при 298К...
 oganyanrobert21.01.2023 13:48
oganyanrobert21.01.2023 13:48 -
9. К основаниям относятся: А) RbOH, Fe(OH)2, В)Na2Co3, C)...
 Нвб23.11.2020 07:37
Нвб23.11.2020 07:37 -
. В какой из реакций: 1-го, 2-го или 3-го порядка превращение...
 sofya1508198714.03.2021 10:42
sofya1508198714.03.2021 10:42 -
Определите количество ионов натрия в растворе Na2SO4 в котором...
 theknow1405.07.2021 12:25
theknow1405.07.2021 12:25 -
Определите опытным путем cacl2, k3po4, k2co3...
 linagurova654523.10.2021 10:13
linagurova654523.10.2021 10:13

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
