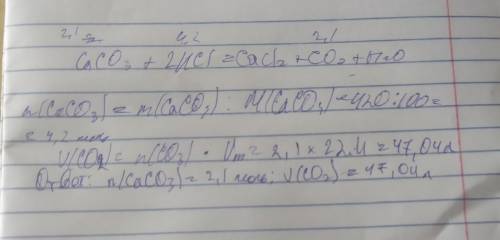Оценка «4» Оформить как задачу: (ДАНО: НАЙТИ: РЕШЕНИЕ:) Задача 2: Для реакции, приведенной в задании 1, рассчитать изменение энтропии.
Решение: Изменение энтропии системы рассчитывается также по следствию из закона Гесса.
Используя приложение 3, определим необходимые для расчетов абсолютные стандартные энтропии исходных веществ и продуктов реакции, не забывая об агрегатных состояниях.
(HCl газ) = 186,7 Дж/(К∙моль)
(О2 газ) = 205,03 Дж/(К∙моль)
(Н2О газ) = 188,74 Дж/(К∙моль)
(Cl2 газ) = 223,0 Дж/(К∙моль)
Подставив указанные значения в приведенную формулу:
получим:
(2 ∙ 188,74 + 2 ∙223,0) – (4 ∙ 186,7 + 205,03) = – 128,35 Дж(К∙моль)
200
226
Ответы на вопрос:
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
0, 2 моль сульфата алюминия растворили В 25 моль воды. Вычислить...
 Dyhanexis06.09.2020 15:45
Dyhanexis06.09.2020 15:45 -
Умоляюю хотябы с 1-6...
 AnastasiaStoyn22.06.2021 19:52
AnastasiaStoyn22.06.2021 19:52 -
До іть будь ласка! терміново ...
 neznayka190025.02.2021 00:55
neznayka190025.02.2021 00:55 -
Определите тип химической связи в оксиде магния и хлориде натрия....
 rminichkina01.02.2021 03:14
rminichkina01.02.2021 03:14 -
с задачей по химии. Сколько граммов соли и воды нужно взять для...
 anadtadiamoroso19.03.2023 10:16
anadtadiamoroso19.03.2023 10:16 -
С 1.Элемент атомының электрондық формуласы 1s2 2s2 2p6 3s2 3p...
 rje8739121.03.2022 12:17
rje8739121.03.2022 12:17 -
Определите массу бензойной кислоты,которую возможно получить...
 hfjfifj27.04.2021 23:50
hfjfifj27.04.2021 23:50 -
Дайте назви оксидам за номенклатурою та класифікуйте (солетворний...
 Miha9655522.02.2020 22:56
Miha9655522.02.2020 22:56 -
Масова частка всіх хімічних елементів zn3(po4)2...
 mineroma50Romaaa24.04.2022 06:58
mineroma50Romaaa24.04.2022 06:58 -
Здравствуйте, существует ли такое вещество - Co3(PO4)3? А то...
 tanya66544424.04.2023 13:33
tanya66544424.04.2023 13:33

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.