Ответы на вопрос:
8.3.4
Дано:
V(р-ра AgNO₃) = 40 мл
ω(AgNO₃) = 6%
ρ(р-ра AgNO₃) = 1,05 гр/мл
V(HCl) = 250 мл = 0,25 л
Найти:
m(AgCl) - ?
1) Для начала мы запишем уравнение реакций, то что известно по условию задачи, именно по такой уравнений реакций мы будем пользоваться:
AgNO₃ + HCl → AgCl↓ + HNO₃
2) Теперь находим массу раствора у нитрата серебра, потом находим его массу чистого вещества у нитрата серебра:
m(р-ра AgNO₃) = V(р-ра AgNO₃)×ρ(р-ра AgNO₃) = 40 мл × 1,05 гр/мл = 42 гр
m(AgNO₃) = (m(р-ра AgNO₃)×ω(AgNO₃))/100% = (42 гр × 6%)/100% = 42 гр × 0,06 = 2,52 гр
3) Теперь находим количества вещества у нитрата серебра и у соляной кислоты, и мы потом определим какой из них в избытке и в недостатке:
M(AgNO₃) = 108 + 14 + 16×3 = 122 + 48 = 170 гр/моль
Vm = 22,4 л/моль
n(AgNO₃) = m(AgNO₃)/M(AgNO₃) = 2,52 гр / 170 гр/моль ≈ 0,0148 моль - в избытке
n(HCl) = V(HCl)/Vm = 0,25 л / 22,4 л/моль ≈ 0,0112 моль - в недостатке
Следовательно:
m(AgCl) = n(HCl) = 0,0112 моль
4) Теперь находим массу образовавшегося осадка:
M(AgCl) = 108 + 35,5 = 143,5 гр/моль
m(AgCl) = n(AgCl)×M(AgCl) = 0,0112 моль × 143,5 гр/моль = 1,6072 гр ≈ 1,6 гр
ответ: m(AgCl) = 1,6 гр
Решено от : 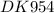
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
А) Уксус, лимонный сок, яблочный сок....
 anavysockaa206030.07.2020 07:59
anavysockaa206030.07.2020 07:59 -
Какую массу имеют 3 • 1024 молекул co2...
 Fox33225.04.2021 14:28
Fox33225.04.2021 14:28 -
Спервыми двумя прошу я по вообще полный нуль...
 fyntikwotoxgtde09.01.2023 14:38
fyntikwotoxgtde09.01.2023 14:38 -
Вычислить число молекул в (nh4)2s массой 6.8г надо !...
 darya2107200521.08.2022 11:20
darya2107200521.08.2022 11:20 -
Складіть структурні формули алканів: 2,2,4 триметилпентан; 2,3,4,4...
 alinag1305200511.10.2020 07:02
alinag1305200511.10.2020 07:02 -
Хлорид цезия (CsCl) электролит или нет?...
 millizza1112.10.2022 10:53
millizza1112.10.2022 10:53 -
, ПРАВДА НАДО установите соответствие...
 Boi1116.11.2020 08:28
Boi1116.11.2020 08:28 -
Знайти відносну молекулярну масу сполук: C2H6O...
 ValiahmetovaKa02.08.2021 14:34
ValiahmetovaKa02.08.2021 14:34 -
1. Даны вещества: сульфат алюминия, гидроксид железа (II), оксид натрия,...
 llovich17.06.2020 05:16
llovich17.06.2020 05:16 -
суміш міститт 0.1 моль заліза та 0.3 моль сірки, потрібно визначити...
 GromovaRus11.07.2022 18:11
GromovaRus11.07.2022 18:11

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
