Які теплові втрати на враховані у даному методі визначення питомої теплоємності речовини?
Ответы на вопрос:
Масса образовавшегося йода 50,8 г.
Объяснение:
Через раствор, содержащий 60 г иодида натрия, пропустили хлор объемом 15,6 л (н.у.). Определите массу образовавшегося йода.
Дано:
m(NaI) = 60 г;
V(Cl₂) = 15,6 л.
Найти: m(I₂).
Решение.
Более сильные галогены вытесняют более слабые из солей. Хлор вытесняет йод из солей.1) Запишем уравнения реакции между иодидом натрия и хлором, в результате которой образуется йод и хлорид натрия.
2NaI + Cl₂ → I₂ + 2NaCl
2) Найдем количество вещества иодида натрия, взятого для реакции.
M(NaCl) = 23 + 127 =150 г/моль.
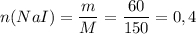 (моль)
(моль)
4) Найдем количество вещества хлора.
По закону Авогадро 1 моль любого газа занимает объем 22,4 л.
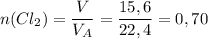 (моль).
(моль).
5) Определим количество выделившегося йода.
По уравнению реакции:
n(NaI) : n(Cl₂) = 2 : 1
У нас даны вещества в отношении
n(NaI) : n(Cl₂) = 0,4 : 0,7 = 2 : 3,5.
Иодид натрия в недостатке, по нему решаем задачу.
По уравнению реакции мольное отношение иодида натрия и йода:
n(NaI) : n(I₂) = 2 : 1 = 0,4 : 0,2.
В результате реакции выделится 0,2 моль йода.
6) Найдем массу выделившегося йода.
M(I₂) = 127 · 2 = 254 г/моль.
m(I₂) = n · M = 0,2 моль · 254 г/моль = 50,8 г.
Масса образовавшегося йода 50,8 г.
#SPJ1
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Расставить степени окисления и показать переход электронов: ch3coch3 +...
 NJazira1130.04.2021 00:59
NJazira1130.04.2021 00:59 -
Составьте уравнения реакций,соответствующих схеме: фосфор-оксид-(v)-фосфорная...
 anna5453p08o2211.12.2022 23:09
anna5453p08o2211.12.2022 23:09 -
Прошу! асположите перечисленные элементы в порядке возврастания значений...
 Апостол1615.05.2023 12:42
Апостол1615.05.2023 12:42 -
Cucl2 alpo4 fepo4 cuno3 их степени окисления...
 Диана1568816.08.2022 02:51
Диана1568816.08.2022 02:51 -
Запишите молекулярное и ионное уравнение между карбонатом калия и фосфорной...
 Дианчик77727.03.2021 09:47
Дианчик77727.03.2021 09:47 -
Напишите реакции гинетических связей: а) na2o - naoh - nahso4 - so3 б)...
 laura3515.08.2020 14:29
laura3515.08.2020 14:29 -
Начертите структурные формулы веществ : c2h4, ch3oh, ch3cl. определите...
 Julia1098812.10.2022 16:41
Julia1098812.10.2022 16:41 -
. Обчислити масу солі, що утвориться при взаємодії надлишку натрій гідроксиду...
 anfisachupina8523.06.2021 09:55
anfisachupina8523.06.2021 09:55 -
Укажіть речовини Х і Y у схемі реакції Х + Y = K3PO4 + H2O ...
 NanaxD02.05.2023 05:34
NanaxD02.05.2023 05:34 -
1 Соотнесите частицу и её название. А) атом 1) Cl Б) молекула 2) K+ В)...
 kuzmichkinvale27.10.2020 01:33
kuzmichkinvale27.10.2020 01:33

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
