Используя метод электронного баланса, составьте уравнение реакции: NO + KOH → KNO2 + N2 + H2O
Определите окислитель и восстановитель.
Ответы на вопрос:
Метод электронного баланса:
1. Пишем степень окисления для каждого элемента сверху. (Показано на фото.)
2. Определяем окислительно-восстановительные процессы:
- Потеря электронов это окисление;
- Получение электронов это восстановление.
2N(+2) + 4e → 2N2(0) - восстановление
4N(+2) - 4e → 4N(+3) - окисление
Пишем количество электронов и сокращаем:
4 | 1
4 | 1
Значит, N2 используется 1 моль. Общая реакция:
6NO + 4KOH → 4KNO2 + N2 + 2H2O
NO является и окислителем, и восстановителем.
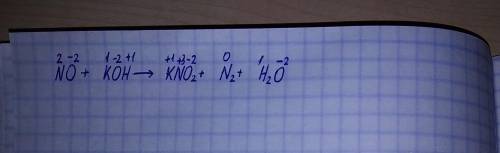
установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления брома в ней.
схема реакции:
+1 +4-2 0 +1-1 +1+5-2 +4-2
а) k2co3 + br2 = kbr + kbro3 + co2
ответ: br₂° > br⁻, от 0 до -1
br₂° > br⁺⁵ \ от 0 до +5
0 0 -1+1
б) br2 + cl2 = brcl
ответ: br₂° > 2br⁻¹ от 0 до -1
в) br2 + i2 = ibr
ответ: br₂° > br⁺¹ от 0 до +1
+1-1 +1+5-2 0 +1-2
г) hbr + hbro3 = br2 + h2o
ответ: br⁻¹> br₂° от -1 до 0
br⁻¹ > br₂°\ от -1 до 0
ответа не нахожу из перечня
1) от -3 до +2
2) от +4 до +5
3) от 0 до +2
4) от +3 до +2
5) от +2 до +4
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Составьте формулы: а) нитрида ; б) карбида ; в) карбоната ; г) нитрата...
 КкапризЗ09.02.2022 18:05
КкапризЗ09.02.2022 18:05 -
Определите массу осадка который образуется при действии избытка нитрата...
 esmirakagraman17.08.2022 07:17
esmirakagraman17.08.2022 07:17 -
Определите степени окисления атомов элементов в фосфате алюминя. объясните...
 SensRow13.05.2022 16:28
SensRow13.05.2022 16:28 -
So3+h20→ написать тип реакции )) ca+o2→ и тут) сuco4+koh→...
 СофияKomarova30.04.2020 11:52
СофияKomarova30.04.2020 11:52 -
Скакими из перечисленных веществ будет реагировать разбавленная серная...
 autosteklo77719.03.2020 15:18
autosteklo77719.03.2020 15:18 -
Вычислите массу металлического серебра, полученного при окислении 600г...
 dedmoros123456714.09.2021 11:32
dedmoros123456714.09.2021 11:32 -
Назовите вещества sio2 h3po4 nacl baso4 укажите к какому классу соединений...
 vvolkova22.01.2021 03:10
vvolkova22.01.2021 03:10 -
Сколько молей хлорида натрия образуется при взаимодействие сульфита...
 molchanets98p085or02.04.2022 23:37
molchanets98p085or02.04.2022 23:37 -
Хватит ли 200г 10%-ного раствора соляной кислоты для полной нейтрализации...
 dzhuliya42355555555509.08.2021 17:39
dzhuliya42355555555509.08.2021 17:39 -
Питання №2 ? 2 бали Укажіть групу речовин, що містить лише солі: CaCl2,...
 Amirkazakov23.01.2023 19:10
Amirkazakov23.01.2023 19:10

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
