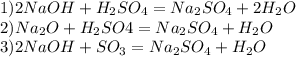Ответы на вопрос:
Объяснение:1
Также существует промышленный взаимодействие серной кислоты с хлоридом натрия при высоких температурах (порядка 550 градусов). Реакция идет следующим образом:
2NaCl + H2SO4 = Na2SO4 + 2HCl
2
Натрий сернокислый также может быть получен при переработке т. н. «фосфогипса» - отходов производства фосфорных удобрений, содержащих сульфат кальция – CaSO4.
3
В лабораторных условиях, можно получить сульфат натрия, воздействуя серной кислотой на соду кальцинированную (натрий углекислый). Реакция идет до конца, поскольку в результате образуется слабая угольная кислота, которая сразу же разлагается на воду и углекислый газ:
H2SO4 + Na2CO3 = Na2SO4 + H2CO3
H2CO3 = H2O + CO2
4
Можно получить сульфат натрия также с реакции нейтрализации (взаимодействием едкого натра с серной кислотой):
2NaOH + H2SO4 = Na2SO4 + 2H2O
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Составьте уравнения реакций в соответствии с описанием: вещество зеленого...
 1Elvira125.10.2020 02:16
1Elvira125.10.2020 02:16 -
Расставьте степени окисления в as4s4...
 aisylu070604.02.2023 12:45
aisylu070604.02.2023 12:45 -
Если при 20с 126,4 насышенный раствор fe2(so4)3 содержит 361.2 *10(22)...
 DedMazaj30.05.2020 18:46
DedMazaj30.05.2020 18:46 -
1)сколько нейтронов имеет h, he, li, be,ne,ar? 2)формулы соединения,...
 koninaes22.11.2021 20:56
koninaes22.11.2021 20:56 -
Верны ли следующие суждения о чистых веществах и смесях? а. молоко —...
 Иa41106.05.2022 20:48
Иa41106.05.2022 20:48 -
Железная пластинка массой 20 г была погружена в раствор нитрата меди...
 Полина111116484485823.03.2023 19:32
Полина111116484485823.03.2023 19:32 -
Вкакой массе воды нужно растворить 30г бромида калия для получения раствора...
 дeд03.03.2023 21:11
дeд03.03.2023 21:11 -
Обчислити кількість карбонатної кислоти, яка утворюється внаслідок взамоєдії...
 kseniy3210.12.2020 05:39
kseniy3210.12.2020 05:39 -
Хлорированиенасветунеизвестногоуглеводородаприводиткмонохлорпроизводному,содержащему22.98...
 eva30118.07.2020 05:59
eva30118.07.2020 05:59 -
Для получения 12,8 г метана при взаимодействии карбида алюминия с водой,было...
 exm0r3d21.10.2020 19:43
exm0r3d21.10.2020 19:43

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.