Определите массу серной кислоты которая вступит вреакцию с 14 грамм алюминия
289
314
Ответы на вопрос:
Привет! Сейчас все запишем:
Дано: m(Al)=14 g , H₂SO₄
I. Запишем реакцию:
2 Al + 3 H₂SO₄ → Al₂(SO₄)₃ + 3 H₂
С реакции видно, что соотношение количества между Аl и серной кислотой - 2:3.
II. Запишем формулы // Проведем вычисления:
n(E)=m(E)/Ar(E)
n(E)=m(E)/Mr(E)
m(E)=n(E)*Mr(E)
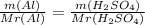
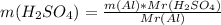
m(H₂SO₄)= 14 * 98 / 27 = 50.81 g
Готово! Есть вопросы? Напишите, с радостью отвечу на них
2nh4cl + h2so4 = (nh4)2so4 + 2hcl1)ищем моли n(nh4)2so4 =m/m=13,2г/132,14 г/ моль=0,099 моль=0,1 моль2)n( h2so4 )=n(nh4)2so4= 0,1 моль3)m(h2so4)=n*m=0,1 моль*98 г/моль=9,8 г4)m(раствора)=m/w=9,8 г/0,25=39,2 гответ : m= 39,2 г
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Составить электронный ! 4ca + 10hno3(разб.) = 4ca(no3)2 + n2o↑ + 5h2o заранее...
 pisturin01.09.2020 16:45
pisturin01.09.2020 16:45 -
Bacl2 + h2so4 = baso4 + 2hcl. сделайте с этим уравнением электронно-ионный...
 kristail200310197908.10.2022 16:23
kristail200310197908.10.2022 16:23 -
Определить массовую долю вещества в растворе, если масса вещества 20 г, а масса...
 залина06123.04.2021 18:18
залина06123.04.2021 18:18 -
Cuo+ cu2so4 p2o5+ h3po4 so3+ k2so4+...
 ukrainahfy02.03.2022 08:12
ukrainahfy02.03.2022 08:12 -
По . найдите формулу вещества. m(в-ва) = 7.5 грамм плотность по водороду (паров)...
 altynai050421.11.2022 03:02
altynai050421.11.2022 03:02 -
Массовая доля углерода в углеводороде составляет 88,9 % . плотность его паров...
 Спаси6008.07.2020 19:09
Спаси6008.07.2020 19:09 -
Напишите названия соединений, используя номенклатуру ИЮПАК по быстрее ...
 6дкоув03.11.2022 03:08
6дкоув03.11.2022 03:08 -
Уравнять хим. реакции и указать их типы : 4б а) Mg(OH)2 + HNO3 → Mg(NO3)2 + H2O...
 Carolina1Cerry26.05.2020 18:46
Carolina1Cerry26.05.2020 18:46 -
Составьте уравнение реакции сульфатной кислоты с такими соединениями: купрум...
 Yuki1608.11.2022 01:02
Yuki1608.11.2022 01:02 -
Составьте уравнения химических реакций, с которых можно осуществить следующие...
 Krupenyapolina04.03.2020 16:17
Krupenyapolina04.03.2020 16:17

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
