55. Калий массой 5,85 г растворили в воде. Полученный раствор нейтрализовали соляной кислотой массой 74,8 г.
Масса раствора после нейтрализации 223,5 г. Какую массу воды использовали для растворения калия? Каковы массо вые доли HCI в соляной кислоте и KCl в конечном растворе? (ответ: 5% KCL, 7,32% HCL, 143г H2O)
Ответы на вопрос:
7.32% HCl; 143 г Воды; 5% KCl
Объяснение:
1) 2K + 2H2O = 2KOH + H2
m(K)= 5.85г
n(K) = 5.85÷39 = 0.15 моль
m(KOH) = 0.15 × 56 = 8.4г
m(H2O) = 18×0.15= 2.7 г
Калий и гидроксид калия относятся друг к другу 1 к 1. Значит гидроксида калия образовалось тоже 0.15 моль
2)KOH + HCl = KCl + H2O
n(KOH) = 0.15
Гидроксид калия и соляная кислота относятся друг к другу как 1 к 1, значит соляная кислота была использована кол-вом 0.15 моль
n(HCl) = 0.15 моль
m(HCl) = 0.15 × 36.5 = 5.475 грамм
w%(р-ра) =
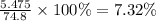
Массовая доля HCl в растворе была 7.32% (ответ 2)
3) Масса раствора после нейтрализации 223.5 г
Если мы отнимем массу раствора соляной кислоты от итоговой массы раствора: 223.5 - 74.8 = 148.7 это масса первого раствора KOH и вода, так как она была в избытке.
148.7 - 8.4 + 2.7 = 143 г Воды (ответ 3)
148.7 - масса первого раствора
8.4 масса KOH
2.7 масса воды, которая вступила в реакцию
4) n(KCl) = 0.15
m(KCl) = 11.175
m(р-ра) = 223.5
w%(р-ра)=
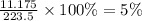
ответ: 5%
Если будут вопросы , отвечу с удовольствием в комментариях.
1) 4al+3o2=2al2o3(реакция идёт под действием температуры)
2) 2al2o3+3h2so4=al2(so4)3+3h2
3) al2(so4)3+6koh=2al(oh)3+3k2so4
4) 2al(oh)3=al2o3+3h2o(реакция идёт под действием температуры).
молекулярные и ионно-молекулярные уравнения смотрите на фотографии.надеюсь,что подчерк поймёте.
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Сколько дерево уходит на один карандаш...
 2018kat14.03.2021 03:58
2018kat14.03.2021 03:58 -
117,6 г. циклогексана подвергнуты дегидрогенизации и полученный бензол хлорирован...
 ybrybrybrybrrby06.03.2022 00:46
ybrybrybrybrrby06.03.2022 00:46 -
До 150г 5% розчину добавили 20г води визначити масову частку новоутвореного...
 Нафаня1337133720.11.2022 20:26
Нафаня1337133720.11.2022 20:26 -
Прошу вас решить умоляю ! вариант 1 1.формула оксида серы(iv): 1) so2 2)...
 natalikc23.04.2022 12:35
natalikc23.04.2022 12:35 -
Напишите уравнения реакции, характеризующие свойства вещества, имещего строение...
 Anakina114.05.2023 00:16
Anakina114.05.2023 00:16 -
До розчину масою 130г з масовою часткою 6% добавили 8г солі обчислити масову...
 Соня1164714.11.2021 07:09
Соня1164714.11.2021 07:09 -
Вдвух пробирках находятся глицерин и этанол. как можно распознать данные...
 kirushgold20.09.2021 23:42
kirushgold20.09.2021 23:42 -
Из перечисленных элементов наибольшей электроотрицательностью в соединениях...
 onaleman01.03.2021 19:20
onaleman01.03.2021 19:20 -
Напишите уравнения следующих превращений ca= cacl2= ca(oh)2= caco3= na2co3...
 Columbos23.10.2020 11:54
Columbos23.10.2020 11:54 -
Смесью является: ! )сахар 2)стекло 3)сера 4)фосфор...
 gjrdghhFafhj31.12.2021 20:01
gjrdghhFafhj31.12.2021 20:01

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.
