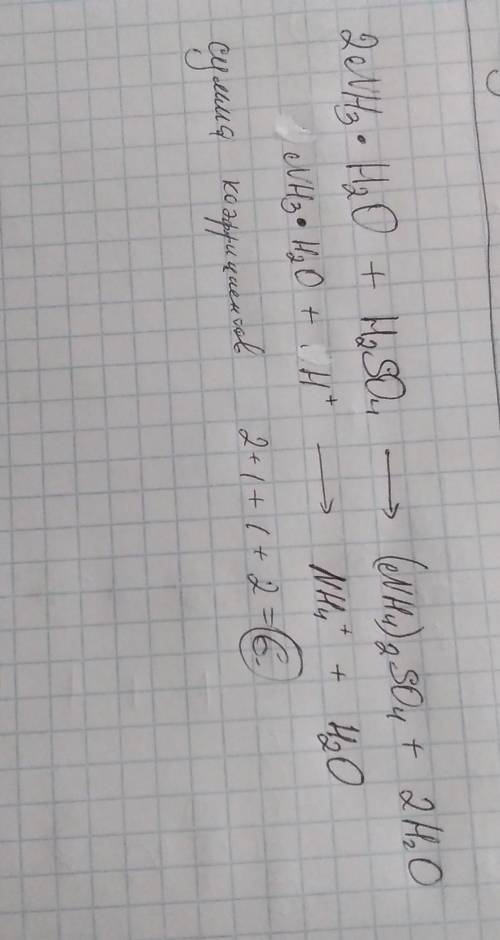Напишите в молекулярном и сокращенном ионном виде уравнение реакции взаимодействия гидроксида аммония с серной кислотой до ее полной нейтрализации. Какова сумма всех коэффициентов в ионном уравнении реакции?
Ответы на вопрос:
ответ: 2NH₄OH + H₂SO₄ ⇒ (NH₄)₂SO₄ + 2H₂O;
Запишем полное ионное уравнение, учитывая, что вода не распадается на ионы (не диссоциирует):
2NH₄⁺ + 2OH⁻ + 2H⁺ + SO₄²⁻ ⇒ 2NH₄⁺ + SO₄²⁻ + 2H₂O;
Сокращаем 2NH₄⁺ в левой и правой части уравнения, тоже самое проделываем с анионом SO₄²⁻, получим сокращенное ионное уравнение:
2H⁺ + 2OH⁻ ⇒ 2H₂O;
Таким образом получаем, что сумма всех коэффициентов в полном ионном уравнении реакции равна 12 (2+2+2+1+2+1+2), а в сокращенном ионном уравнении она равна 6 (2+2+2)
Если же говорить про сумму коэффициентов в обычном ( молекулярном) уравнении реакции, то она равна 6 (2+1+1+2)
Объяснение:
Формула ортофосфата натрия Na₃PO₄
Формула для вычисления массовой доли элемента в сложном в-ве:
ω(Э) = nAr(Э)/Мr(в-ва)
то есть сумму относительных атомных масс элемента разделить на относительную молекулярную массу, можно выразить в долях или в процентах.
Вычисляем относительную молекулярную массу ортофосфата натрия, используя ПСХЭ Д.И. Менделеева.
Mr(Na₃PO₄) = 3Ar(Na) + Ar(P) + 4Ar(O)
Mr(Na₃PO₄) = 3*23+31+4*16 = 164
ω(Na)= 69/164 = 0,42 или 42%
ω(P)=31/164 = 0,19 или 19%
ω(O)=64/164 = 0,39 или 39%
Подробнее - на -
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Какую массу оксида магния можно получить при реакции 48г магния с 44 л...
 polinamunteanu10.09.2021 01:03
polinamunteanu10.09.2021 01:03 -
До гліцерину масою 460 г додали натрій масою 276 г. Об єм (н. у.) утвореного...
 maklakovatattu05.04.2021 09:21
maklakovatattu05.04.2021 09:21 -
Кальцій нітрат можна добути внаслідок взаємодії А) кальцій оксиду і барій...
 helpme14806.04.2022 19:45
helpme14806.04.2022 19:45 -
Обчисліть масу розчину (в грамах), для приготування якого використали 200...
 Ди121801.08.2020 12:26
Ди121801.08.2020 12:26 -
Методом електронного балансу розставте коефіцієнти в рівнянні окисно- відновної...
 ник504309.10.2020 03:15
ник504309.10.2020 03:15 -
Який об’єм води (мл) може прореагувати з кальцій оксидом, маса якого становить...
 Солнцеголовик26.04.2021 11:24
Солнцеголовик26.04.2021 11:24 -
Напишите качественные реакции Вторбутилхлорид метилдиэтилуксусный альдегид...
 cyrkunova5601.05.2020 13:58
cyrkunova5601.05.2020 13:58 -
Запишите уравнения типичных реакций для схем Соль + металл = другая соль...
 maksimesaulav4616.05.2022 06:37
maksimesaulav4616.05.2022 06:37 -
Найди суммарное количество электронов, отданных восстановителем окислителю...
 алла778125.04.2022 06:20
алла778125.04.2022 06:20 -
Наливаємо у пробірку 1-2 мл.розчину купрум (II)сульфату та доливаємо 1-2...
 ekicinurzulal20.07.2022 22:46
ekicinurzulal20.07.2022 22:46

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.