При сжигании 36 г органического соединения получено 52,8 г углекислого газа и 21,6 г воды. Молекула соединения имеет массу 29,9·10−23 г. Данное вещество существует в виде изомеров, превращающихся друг в друга, и может вступать в реакцию брожения. На основании этих данных: 1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества; 2) установите молекулярную формулу исходного органического вещества; 3) составьте структурную формулу одного из циклических изомеров вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) приведите уравнение реакции сгорания данного вещества. ДАНО + РЕШЕНИЕ
275
338
Ответы на вопрос:
C₆H₁₂O₆
Объяснение:
Дано:
m(CxHyOz)=36г
m(CO2)=52,8г
m(H2O)=21,6г
m(молек)=29,9*10⁻²³г
Найти:
CxHyOz-?
1.
CxHyOz+nO2=xCO2+(y/2)H2O
m(C)=m(CO2)/M(CO2)*Ar(C)=52,8/44*12=14,4г
m(H)=2*m(H2O)/M(H2O)*Ar(H)=2*21,6/18*1=2,4г
m(O)=m(CxHyOz)-m(C)-m(O)=36-14,4-2,4=19,2г
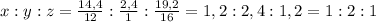
M(CxHyOz)=m(молек)*Na=29,9*10⁻²³*6,02*10²³=180г/моль
12*x+1*2*x+16*x=180
30*x=180
x=6
y=12
z=6
2.
C6H12O6
3.
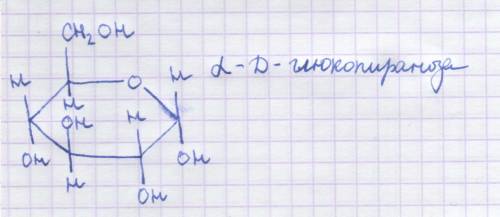
Многие вещества с формулой C6H12O6 подвергаются брожению, будем считать, что перед нами глюкоза, формула α-D-глюкопиранозы на картинке.
4.
C6H12O6+6O2=6CO2+6H2O
Реши свою проблему, спроси otvet5GPT
-
Быстро
Мгновенный ответ на твой вопрос -
Точно
Бот обладает знаниями во всех сферах -
Бесплатно
Задай вопрос и получи ответ бесплатно

Популярно: Химия
-
Написать определение видам химической связи, Солям,основаниям,...
 StefaMusic200616.08.2021 16:50
StefaMusic200616.08.2021 16:50 -
2. Составьте структурные формулы следующих веществ: а) 2,4-диметилгексан;...
 fedya3308.08.2020 05:40
fedya3308.08.2020 05:40 -
Көмектесіңдерші братандар( А В С тапсырмалар...
 raminowka04.04.2020 09:45
raminowka04.04.2020 09:45 -
Оксид серы(VI) при 20 °C – это: а) бесцветная жидкость; б) бесцветный...
 слава49917.08.2021 04:51
слава49917.08.2021 04:51 -
Относительная плотность органического соединения по гелию равна...
 Syrtou23.02.2021 17:18
Syrtou23.02.2021 17:18 -
11. Смесь порошков железа и серы можно разделить с : А) возгонки...
 Deniska777120.01.2022 23:49
Deniska777120.01.2022 23:49 -
Имеются 10 % растворы этиленгликоля, глицерина, глюкозы. В каком...
 Dimas169404.06.2022 12:31
Dimas169404.06.2022 12:31 -
Яка масова частка розчиненої речовини хлоридної кислоти міститься...
 66y5tnvjoxr5x707.04.2023 18:41
66y5tnvjoxr5x707.04.2023 18:41 -
При сгорании 3 моль предельного одноатомного спирта образовалось...
 shabanovkirillp02mew09.08.2022 02:05
shabanovkirillp02mew09.08.2022 02:05 -
14. Для разделения смеси сахарного песка с водой используют: A)...
 youtubeadamchuk08.11.2020 00:34
youtubeadamchuk08.11.2020 00:34

Есть вопросы?
-
Как otvet5GPT работает?
otvet5GPT использует большую языковую модель вместе с базой данных GPT для обеспечения высококачественных образовательных результатов. otvet5GPT действует как доступный академический ресурс вне класса. -
Сколько это стоит?
Проект находиться на стадии тестирования и все услуги бесплатны. -
Могу ли я использовать otvet5GPT в школе?
Конечно! Нейросеть может помочь вам делать конспекты лекций, придумывать идеи в классе и многое другое! -
В чем отличия от ChatGPT?
otvet5GPT черпает академические источники из собственной базы данных и предназначен специально для студентов. otvet5GPT также адаптируется к вашему стилю письма, предоставляя ряд образовательных инструментов, предназначенных для улучшения обучения.

